-
抗体試薬
- フローサイトメトリー用試薬
-
ウェスタンブロッティング抗体試薬
- イムノアッセイ試薬
-
シングルセル試薬
- BD® OMICS-Guard Sample Preservation Buffer
- BD® OMICS-One Protein Panels
- BD® AbSeq Assay
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ ATAC-Seq Assays
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Accessory Kits
- BD® OMICS-One Immune Profiler Protein Panel
- BD OMICS-One™ WTA Next Assay
-
細胞機能評価のための試薬
-
顕微鏡・イメージング用試薬
-
細胞調製・分離試薬
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location site or be switched to your location?

Cell-Based Assays
細胞ベースのアッセイは、増殖、生存率、アポトーシス、調節ネットワークなどの細胞プロセス、およびリン酸化やサイトカイン分泌などの細胞の機能的側面を測定します。 細胞ベースのアッセイを使用して、目的の経路全体を調べることができ、複数のステップを測定して、細胞内で実際に起こっていることの機能的な読み取りを行うことができます。 BD Biosciencesは、細胞内サイトカインシグナル伝達、細胞周期、細胞生存率および増殖の測定; リン酸化アッセイのための試薬を提供しています。
生と死, そして細胞増殖解析
真核細胞の細胞の成長、複製、分裂は、細胞周期と呼ばれる高度に制御された一連のイベントに従って発生します。 適応免疫では、特定のTリンパ球とBリンパ球が、外来の抗原刺激に応答してクローンの拡大(分裂、増殖、分化)を起こします。 フローサイトメトリー、免疫蛍光法、または免疫組織化学を使用して、細胞周期の状態を迅速に判断し、代理で刺激に対する細胞の反応を判断することができます。
細胞のDNA含量測定による細胞周期解析
細胞周期研究では主にDNA含量を解析します。 解析するための試薬は、例えば、ヨウ化プロピジウム (PI)や7-アミノアクチノマイシンD (7-AAD)等のDNA染色剤があります。DNA染色剤の他、より精確なDNA測定を可能にするために、タンパクやRNAを分解する試薬を使用することもあります。(BD Cycletest Plus reagent kit) その後、倍数性の評価や、異常DNAを有する系統の同定、DNAインデックス(DI)や種属系統の細胞周期の分布評価のため、フローサイトメトリーを使ってサンプルを分析します。 (see the figure below).
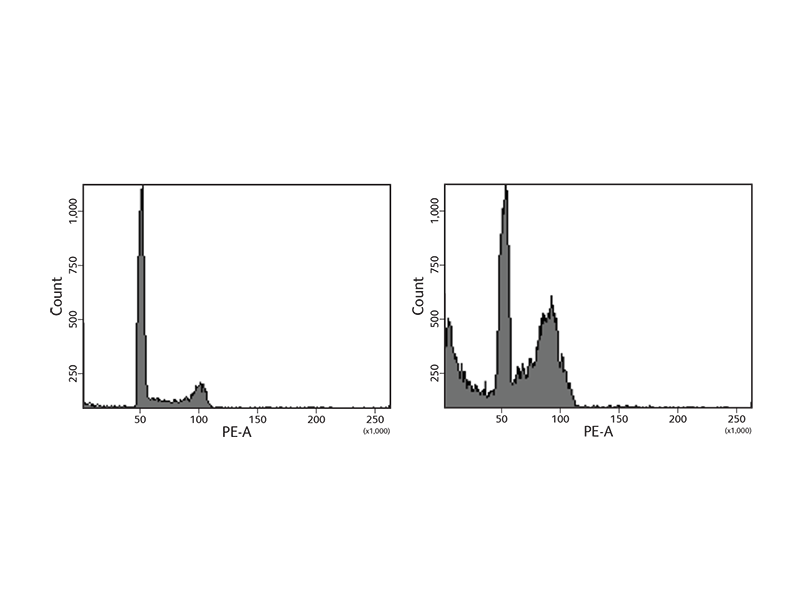
細胞が細胞周期の段階を進んでいくに従って、ヒストンH3 Ser28等のタンパクは、修飾を受けたり、発現量が変化したりします。DNAの複製を促進させるため、ヒストンは修飾され、複製機構が入れるようにクロマチンを開きます。 細胞周期研究をサポートするため、BD バイオサイエンスは、イメージングやフローサイトメトリーに適したこれらのタンパクに対する抗体を揃えています。
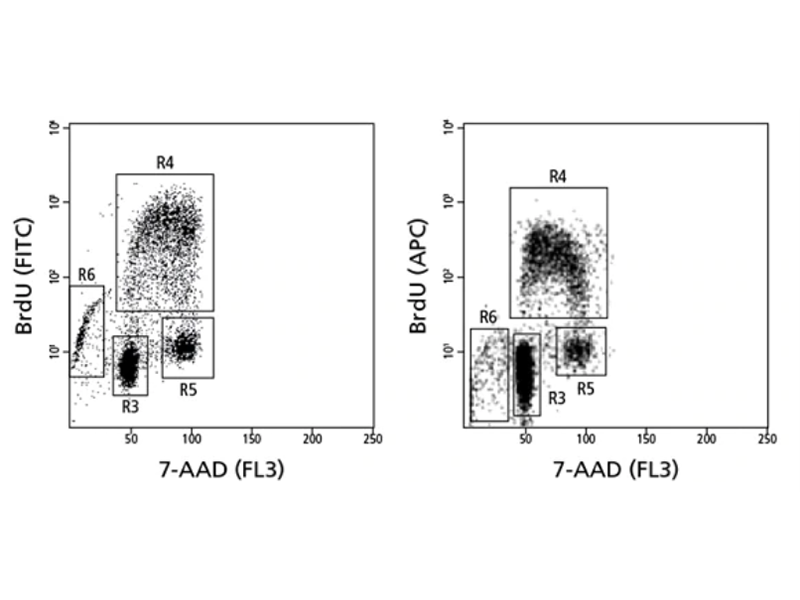
取り込まれたBrdUおよび総DNA量 (7-AAD)の染色による細胞周期解析
細胞周期解析 のためのBD Biosciencesソリューションの詳細をご覧ください。
ヒトPBMCを抗CD3 / CD28で48時間刺激し、PMA +イオノマイシンで4時間再刺激し、最後の1時間にBrdUを添加しました。 次に、細胞を回収し、BrdU染色プロトコルを使用して染色しました。 ゲートR3にはG0期の細胞が含まれ、ゲートG4にはS期の細胞が含まれ、ゲートR5にはG2 / M期の細胞が含まれ、ゲートR6には核酸含有量が失われ始めているアポトーシス細胞または壊死細胞が含まれます。
細胞増殖解析
細胞増殖は、成長と分裂の結果としての細胞数の増加です。 細胞増殖とアポトーシスのバランスは、発達と正常組織の恒常性の両方にとって重要です。 サイトカイン処理や精製抗体との受容体架橋などの複数の刺激は、細胞増殖に影響を与える可能性があります。
BrdUによる細胞増殖解析
新規DNA合成の測定には、DNA前駆物質チミジンのアナログである、ブロモデオキシウリジン(BrdU)を用います。.
細胞周期のS期(DNA合成)の間、BrdUは新しく合成されたDNAに取り込まれ、抗BrdU特異的抗体によって容易に検出することが出来ます。BrdU検出用に開発されたBDの抗体およびキットは、細胞内フローサイトメトリー用と免疫組織化学用のBDHorizon™Violet 450(V450)、BD Horizon BrilliantViolet™510(BV510)、BDPharmingen™PerCP-Cy5.5などが含まれた試薬があります。
DNA増加に加え、ある種のタンパクのレベルも細胞増殖によって上昇します。例えば、Ki67は分裂中の細胞の核で発現される抗原です。しかし、細胞周期のG0期の間は検出されません。さらに信頼性を増すために、Ki67を、BrdUやVPD450等の他の増殖マーカーと組み合わせることも可能です。これらのマーカーを細胞表面抗原や他のタイプのマーカーと組み合わせて、さらに細胞のサブセットやその情報伝達経路に関する知見を得ることも可能です。
アポトーシスと細胞死の解析
アポトーシスのプロセスは、ある種の形態学的特徴を有します。それらは、細胞膜の変化(膜対称性の喪失、膜接着の喪失など)、細胞質と核の凝縮、タンパクの切断、およびDNAのヌクレオソーム間切断などを含みます。プロセスの最終段階で、死につつある細胞は「アポトーシス小体」へと断片化した状態になり、その結果周囲の細胞に有意な炎症性傷害を及ぼすことなく、食細胞によって除去されます。BD Biosciencesは、アポトーシスプロセス全体のさまざまな段階でインジケーターを測定するためのアポトーシス検出ツールとテクノロジーを幅広く提供しています。
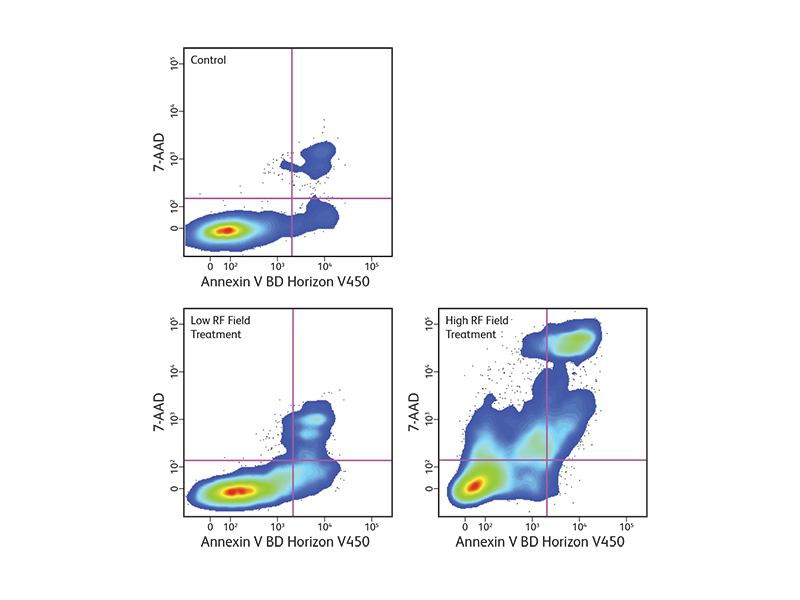
Annexin V—アポトーシスのメカニズムにおける重要なシグナル
細胞膜の変化は、生細胞で検出されるアポトーシスプロセスの最初の特徴の1つです。通常は細胞膜の細胞質側に位置するフォスファチジルセリン(PS)の存在によって検出することが出来ます。アポトーシスの間、PSは細胞膜の外葉に移動し、カルシウム存在下、蛍光色素でラベルしたAnnexin Vに結合することにより、フローサイトメトリーや細胞イメージングによって検出することができます。
BD Biosciencesは、FITC, PEのみでなく、Violet laserに対応するためのBD Horizon™ BV421やUV laserに対応するためのBD Horizon Brilliant™ UV 395 (BUV395)が標識されたAnnexin Vも提供しています。これにより、幅広いパネルに対応することが可能になります。
細胞膜が損傷すると細胞内Annexin Vも露出されるので、死細胞を除外するため、アポトーシスを起こした細胞と既に死んでいる細胞を区別する、7-AAD等の細胞膜不透過性染色剤が一般的に用いられます。Annexin Vで染まった細胞集団は、アポトーシスを起こした細胞集団を表しています。
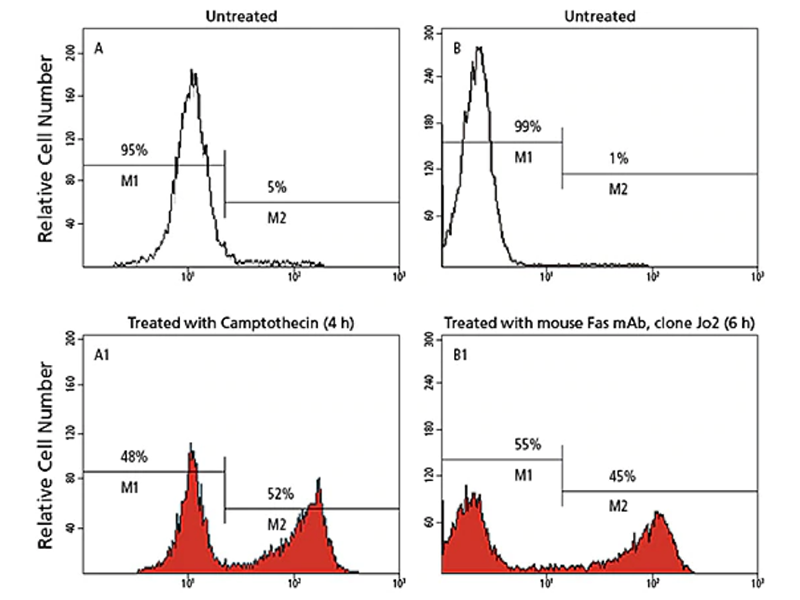
切断型Caspases及びPARPの測定
Caspasesは、アポトーシスの重要なイニシエーターです。 アポトーシスの最も早期に、かつ最も一貫して見られる特徴の1つは、細胞質プロテアーゼCaspaseの活性化です。アポトーシスが活性化されると、Caspaseは複数のタンパク基質を一斉に切断して、細胞の構造と機能を喪失させ、最終的に細胞死に至らしめます。特に、Caspase8、-9および-3はアポトーシスに関与し、Caspase9はミトコンドリア経路、Caspase8はFas/CD95経路、そしてCaspase3はより下流で働き、複数の経路によって活性化されます。
BD バイオサイエンスは、フローサイトメトリー、イメージング、ELISAなどで使用できる様々な抗体から、個々の蛍光発生ペプチド基質や阻害剤、キット、すぐに使えるアッセイプレートまで、Caspase活性の測定における幅広いツールを提供いたします。
切断型Caspase-3 /阻害剤の影響
Active caspase-3は蛍光発生Ac-DEVD-AMC基質に結合し、アスパラギン酸(D)とAMCの間で切断し、蛍光AMCを放出します。 AMC蛍光は、分光蛍光光度法によって定量化されます。Ac-DEVD-CHOアルデヒド阻害剤は、カスパーゼ3活性部位に強く結合し、基質結合をブロックします。 したがって、Ac-DEVD-AMCは切断されず、蛍光は放出されません
BDBiosciencesはいくつかを提供しています protocols for analyzing cell cycle, proliferation, cell death and apoptosis.
リン酸化タンパク質の 解析
チロシン、セリン、およびスレオニン残基のリン酸化は、さまざまな細胞イベントに関与するタンパク質活性の制御に重要です。キナーゼとホスファターゼの品揃えは、TおよびB細胞シグナル伝達、アポトーシス、成長、細胞周期制御を調節する経路、さらにサイトカイン、ケモカイン、ストレス応答に関与する経路など、多くの異なる細胞シグナル伝達経路における細胞内タンパク質リン酸化を調節します。歴史的に、リンタンパク質の検出は、放射性キナーゼアッセイやホスホアミノ酸標識などの技術を使用して行われてきました。しかし、リン酸化特異的抗体の出現により、ウエスタンブロッティング、免疫沈降、免疫蛍光顕微鏡法などのより簡単な技術の使用が容易になりました。ただし、これらの手法には、比較的大量のサンプルを必要とし、時間がかかり、真に定量的な結果が得られず、マルチパラメータ分析に不向きであるという欠点がありました。sis.
抗リン酸化抗体を開発することにより、フローサイトメトリーにおけるリン酸化タンパク質の解析が可能になりました。フローサイトメトリーで、BD Phosflow™ Reagentsを用いて解析すると、少量のサンプルでシングルセルレベルで、ヘテロな細胞集団からの解析が可能になります。 .
High-content cell imagingを用いることにより、細胞微小環境におけるリン酸化タンパク質を可視化し、解析することが可能になります。
リン酸化タンパク質の解析: BD Phosflow™ 試薬のテクノロジー
革新的なBD Phosflow™試薬テクノロジーは、リン酸化イベントに関する細胞内メカニズム解明することのできる、初めてのフローサイトメトリーソリューションでした。BD Phosflow™試薬アプローチは、シグナル伝達タンパク質のリン酸化が特定のT細胞表現型の発現につながるT細胞の研究に特に役立ちます。
サンプルごとのBD Biosciences BD Phosflow™ プロトコールを掲載しています。
BD Cytofix/Cytoperm™ 試薬の方法
BD Cytofix/Cytoperm™ 試薬は、 フローサイトメトリーにおける細胞内サイトカイン測定に有用な試薬です。BD Biosciencesは、細胞内サイトカイン測定に役立つ様々なソリューションを提供しています。.
BD FastImmune™ 試薬
BD FastImmune™システムは、ヒトサンプルの応用研究のニーズを満たすように設計されています。完全なシステムに焦点を当てたこのアプローチは、病気の間の免疫状態、またはワクチン候補に対する免疫反応を監視する研究研究に非常に適しています。BD FastImmune™CD4細胞内サイトカイン検出キットAnti-Hu-TNF-α/ CD69 / CD4 / CD3は、全血中の抗原活性化CD4 + Tリンパ球における細胞内サイトカインおよび活性化マーカーCD69の検出用に設計されています。アプリケーションには、ヘルペスウイルス、HIV、腫瘍抗原などの抗原に対するT細胞応答の研究が含まれます。BD Biosciencesは、細胞内フローサイトメトリーを通じて細胞内サイトカインを測定するためのいくつかのソリューションを提供しています
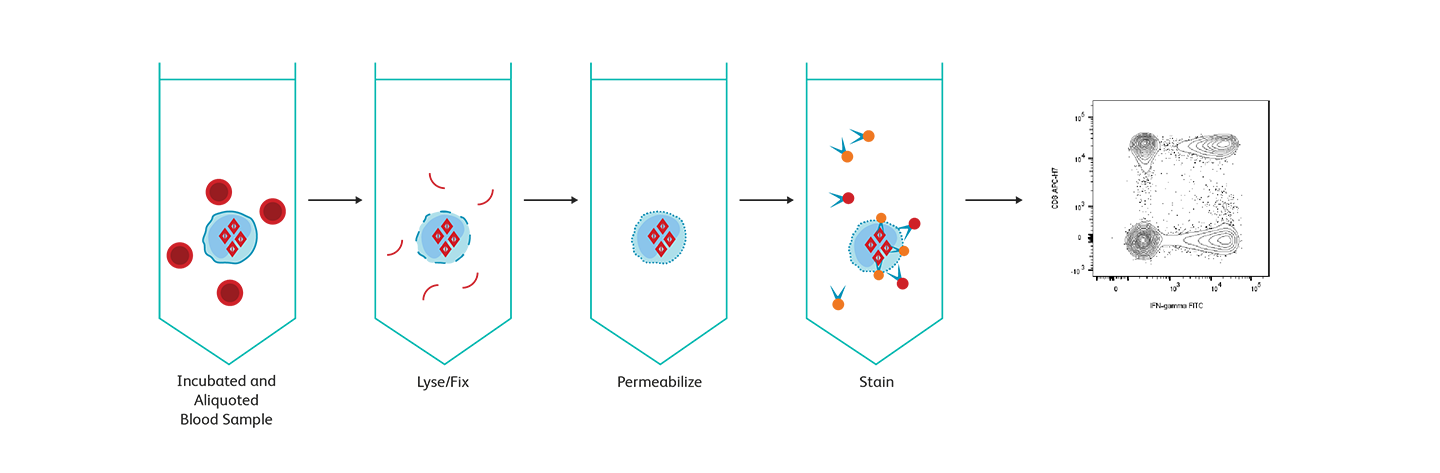
細胞内 サイトカインの解析
細胞内タンパク質を検出するには、細胞を固定して透過処理し、蛍光抗体が目的の標的タンパク質に侵入して検出できるようにする必要があります。抗原が異なれば、固定と透過処理に対する感度と要件も異なり、プロトコルの追加の最適化が必要になります。分泌タンパク質であるサイトカインを検出するには、細胞内にタンパク質を貯蔵するタンパク質輸送阻害剤が必要です。BD Biosciencesは、細胞内サイトカイン検出に広く使用されている2つのアッセイシステムを提供しています。BD Cytofix/ Cytoperm™試薬とBD FastImmune™サイトカインシステムです。どちらのシステムも、一緒に使用するために最適化され、BDフローサイトメトリー製品で知られている高水準の品質と再現性を組み込んだ試薬とプロトコルを使用することの容易さと自信を研究者に提供します。BD Phosflow™試薬は、マルチカラーフローサイトメトリーを使用して、T細胞シグナル伝達に関与するリン酸化タンパク質のレベルを測定し、データをサブセットの同定と組み合わせるのに役立ちます。
分泌サイトカインの測定(可溶性因子)
サンプル内の分泌サイトカインを検出するために、BDは複数のアッセイを提供しています。BD® Cytometric Bead Array (CBA) テクノロジーにより、複数の可溶性サイトカインを同時に定量できます。BD OptEIA™ ELISA 試薬は、単一のサイトカインの定量用に設計されています。BD® ELISPOT 試薬はサイトカイン産生細胞の頻度の測定を可能にし、BD®InVivo CaptureAssaysはinvivoでサイトカインを直接捕捉することにより定量を可能にします。
BD Biosciencesは、 ELISAs and other immunoassaysのプロトコールを提供しています。
Chemokines and chemokine receptors の測定
走化性アッセイとカルシウム動員アッセイは、ケモカインとその受容体の生物学的活性を特徴づけるために使用されます。
Chemotaxis アッセイ
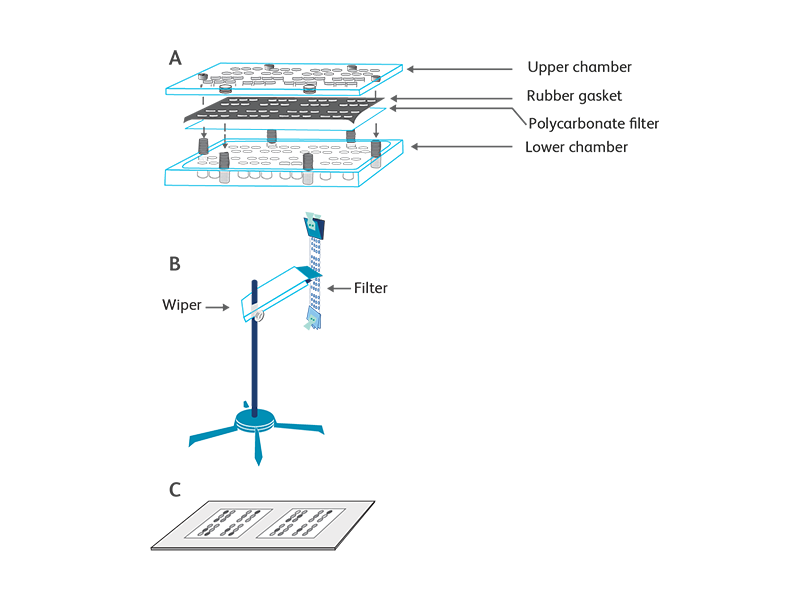
走化性アッセイは、ケモカイン勾配に応じた標的細胞の方向性移動に基づいています。 ほとんどのアッセイに使用される装置は、1960年代に開発されたボイデンチャンバーです1。 現代の走化性アッセイは、細胞外マトリックスタンパク質(例えば、コラーゲン、フィブロネクチン)または内皮細胞単層で膜をプレコートするなどのいくつかの変更を適応させて、インビボ環境を模倣している。 BD Biosciencesで採用している走化性アッセイでは、48ウェルの走化性チャンバー (Neuro Probe, Cabin John, MD)を利用しています。2
細胞溶解時に乳酸デヒドロゲナーゼ(LDH)を測定することにより、遊走した細胞を数える別の修正された走化性アッセイも、ケモカインの生物学的活性を決定するために使用されます。 簡単に説明すると、3または5μmのポアサイズのメンブレンを備えたトランスウェルインサートを、コントロールとケモカインを含む24ウェルプレートのウェルに懸濁します。 標的細胞はトランスウェルインサートに追加されます。 インキュベーション後、遊走した細胞の数はLDHアッセイによって決定されます。 放出されるLDHの量は、テトラゾリウム塩(INT)の赤いホルマザンへの酵素的変換に比例します。これは、ELISAプレートリーダーを使用して490nmの波長の光で簡単に測定できます。
Calciumアッセイ
細胞質ゾルの遊離Ca2 +濃度([Ca2 +] i)の一時的な増加は、細胞シグナル伝達に関与する多くのリガンド膜貫通受容体システムの細胞活性化の指標を提供することができます。このため、リガンドによって引き起こされる、または活性化リガンドまたはその受容体に対する抗体によって防止される一過性の[Ca2 +] InFluxのレベルを測定するアッセイを使用して、これらの生物学的に活性な分子のレベルおよび比活性を決定することができます。
カルシウムイオンは細胞内シグナル伝達において独特の役割を果たしており、細胞シグナル伝達経路の重要なセカンドメッセンジャーであると考えられています。ケモカイン、アナフィラトキシン、およびその他の炎症性メディエーターは、それらの細胞受容体に結合するとカルシウム動員反応を引き起こす可能性があります。これらの場合、受容体-リガンド相互作用は、膜の内側にあるグアニンヌクレオチド結合タンパク質を活性化します。その結果、ヘテロ三量体Gタンパク質は、ホスホリパーゼCを活性化して、ホスファチジルイノシトール4,5-二リン酸を切断し、ジアシルグリセロールとイノシトール三リン酸を放出します。イノシトール三リン酸は細胞内貯蔵からのCa2 +の放出を引き起こしますが、ジアシルグリセロールと細胞質ゾルのCa2 +レベルの増加は、細胞内のプロテインキナーゼCの活性化に関係しています。リン酸化イベントの増加は、これらの活性化された細胞による酸化剤の生成と分泌機能に関連しています。
Indo-1やFura-2など、Ca2 +と複合体を形成すると蛍光特性が変化する、さまざまな蛍光指示薬が利用可能です。たとえば、励起光の波長を約358 nmに設定した分光蛍光光度計を使用すると、Indo-1の最大蛍光発光はCa2 +を含まない培地での約485nmから色素がCa2 +で飽和した場合の約405nmにシフトします。Ca2 +結合色素とCa2 +フリー色素の蛍光比を使用して[Ca2 +] iを決定できます。これらの色素の細胞透過性アセトキシメチル(AM)エステルは、細胞内に受動的にロードすることができ、細胞内エステラーゼによって細胞不透過性生成物に切断されます。カルシウム動員アッセイを実行するために、標的細胞にIndo-1をロードし、分光蛍光光度計内の温度制御された(37 C)攪拌キュベットに入れ、358nmの波長の光で励起します。405および485nmでのベースライン発光を決定した後、刺激物(ケモカイン、アナフィラトキシン、またはその他の炎症性メディエーター)を細胞懸濁液に迅速に注入します。放出された蛍光信号は継続的に監視され、次の120〜300秒間記録されます。
放出の比率(E405 / E485)に反映されるように、細胞質ゾルの遊離Ca2 +のレベルは、リガンドが刺激性である場合、急速に増加します。(すなわち、その受容体に細胞内のシグナルを伝達させ、細胞内貯蔵から細胞質ゾルへのCa2 +の動員をもたらす)。この応答に続いて、[Ca2 +] iがベースラインレベルに戻ります。 細胞質ゾルの遊離Ca2 +の一時的な増加の振幅は、ED50の決定を可能にする標的細胞を活性化するために使用される刺激性リガンド濃度に依存します。
その他の方法
上記の方法に加えて、特定のケモカインの生物学的活性を決定するためにいくつかの方法が使用されてきました。これらには、CCおよびCXCケモカインの両方に対するCD11b / CD18アップレギュレーションアッセイが含まれます。 好中球エラスターゼまたはβ-グルクロニダーゼ放出アッセイおよびCXCケモカインの好中球酸化バーストアッセイ、MIP-1αおよびMIP-1βの造血コロニー形成アッセイ、CCケモカインのヒスタミン放出アッセイなどです。
References
- Boyden S. The chemotactic effect of mixture of antibody and antigen on polymorphonuclear leukocytes. J Exp Med. 1962;115(3):453-466. doi: 10.1084/jem.115.3.453
- Leonard EJ, Sylvester I, Yoshimura T. Measurement of human neutrophil attractant protein-1 (NAP-1; IL-8). In Coligan JE, Kruisbeek M, Margulies DH, Shevach EM, Strober W, eds. Current Protocols in Immunology. Greene Publishing Associates and Wiley-Interscience; 1992.
- Nachlas MM, Margulies SI, Goldberg JD, Seligman AM. The determination of lactic dehydrogenase with a tetrazolium salt. Anal Biochem. 1960;1:317-326. doi: 10.1016/0003-2697(60)90029-4
For Research Use Only. Not for use in diagnostic or therapeutic procedures.
Cy is a trademark of Global Life Sciences Solutions Germany GmbH or an affiliate doing business as Cytiva.
23-23173-00