-
抗体試薬
- フローサイトメトリー用試薬
-
ウェスタンブロッティング抗体試薬
- イムノアッセイ試薬
-
シングルセル試薬
- BD® OMICS-Guard Sample Preservation Buffer
- BD® OMICS-One Protein Panels
- BD® AbSeq Assay
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ ATAC-Seq Assays
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Accessory Kits
- BD® OMICS-One Immune Profiler Protein Panel
- BD OMICS-One™ WTA Next Assay
-
細胞機能評価のための試薬
-
顕微鏡・イメージング用試薬
-
細胞調製・分離試薬
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location site or be switched to your location?

Rheumatology
関節リウマチ(RA)、ループス、多発性硬化症などのリウマチ性疾患は自己免疫応答が原因で発症します。免疫不全症では免疫系が適切な免疫応答を誘導できなくなりますが、自己免疫疾患では免疫系が自己抗原に過剰応答します。このように自己と非自己を区別できなくなるのは、免疫寛容が破綻し、免疫系に備わっている予防機構によって自己攻撃を防がなければならなくなるためです1。自己免疫は、特定の器官に影響を及ぼしたり(RA)、全身に影響を及ぼしたり(ループス)します。強直性脊椎炎などの一部の疾患は、自己免疫性かつ炎症性の関節疾患と考えられています。
Examples of rheumatic diseases
関節リウマチ(RA)は、手足を含む全身の関節の炎症および損傷を特徴とする自己免疫疾患で、米国では人口の約0.5~1%に発症し、男性よりも女性に多く見られます2。
全身性エリテマトーデス(SLE)は慢性炎症性自己免疫疾患です。SLEは、自己抗体を産生することにより、皮膚、腎臓、肺、中枢神経系などの複数の器官に発症します3。
強直性脊椎炎(AS)は軸性筋骨格系の慢性進行性炎症性リウマチ性疾患で、複数の遺伝子が原因となって発症します4。
Genetic basis of AS
リウマチ性疾患には遺伝的要因が強く関与しています。特に、ヒト白血球抗原(HLA)座はリウマチ性疾患に対する遺伝的素因の約50%を占めており、主要組織適合遺伝子複合体(MHC)クラスII分子であるHLA-DRB1が強く関与しています4。その他の非HLA感受性遺伝子(タンパク質アルギニンデイミナーゼ4型[PADI4]やインターロイキン2受容体サブユニットαなど)もリウマチ性疾患に関与しています。
ASにはMHCクラスI分子であるHLA-B27が強く関連しています。HLA-B27検査は強直性脊椎炎のスクリーニングのためにルーチンで行われます5,6。
BD Biosciences tool for rheumatic disorders
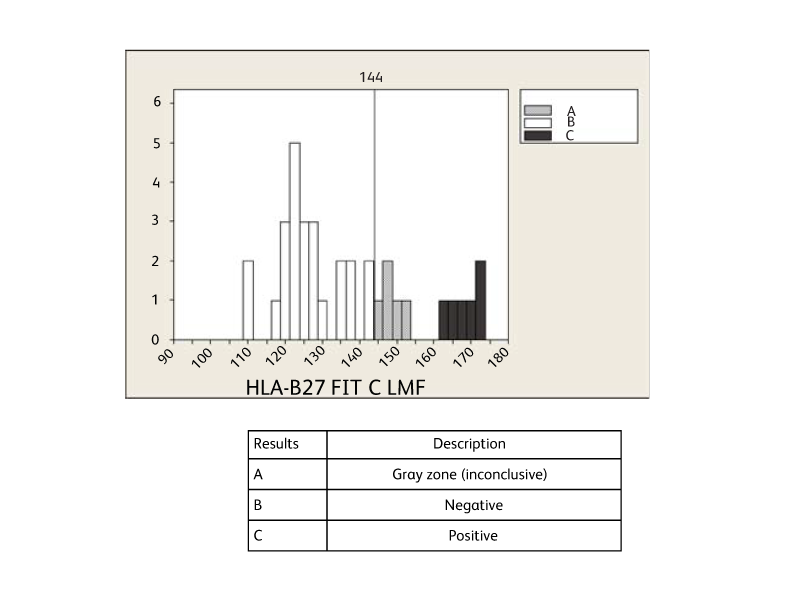
BD Biosciencesでは、リンパ球表面HLA-B27抗原の有無をスクリーニングするためのツールをご用意しております。HLA-B27の存在は、リウマチ性疾患の1つである強直性脊椎炎と強く関連しています。 BD® HLA-B27キットは、BD社製フローサイトメトリーシステムを用いて、赤血球溶解全血中のHLA-B27抗原発現を迅速に検出します。
精度試験
| Precision | SD of LMF |
|---|---|
| Within Run | 0.7 |
| Between Instruments | 1.3 |
| Between Days | 0.8 |
| System Total | 1.5 |
10個のサンプル(陽性サンプル5個と陰性サンプル5個)を用いて、BD FACSCanto™システムのHLA-B27抗原に対する精度を推定しました。測定は2日間にわたって1日2回行われ、BD FACSCanto™機器3台を用いて3名の操作者が実施しました。各変数のHLA-B27 FITC LMF平均値のSDを算出しました。
交差反応性特性評価
BD® HLA-B27試験に用いた抗HLA-B27モノクローナル抗体GS145.2は、HLA-B7と最もよく交差反応することが明らかにされています7。交差反応性を示す一部のサンプルのLMFは決定マーカーの陽性側に傾き、結果が偽陽性となる可能性があります。このような交差反応性の特性を明らかにするために試験を実施しました。細胞毒性試験または低分解能分子試験により確認された、既知のHLA-B交差反応性抗原を持つ29個のサンプルと、6個のHLA-B27陽性サンプルを、3回ずつ染色し、3名の操作者がそれぞれにBD FACSCanto™機器2台を用いて捕捉しました。確認された6個のHLA-B27陽性サンプルはすべて、決定マーカーを上回っていました。5個の偽陽性サンプルは主にHLA-B7でした。
References
- Wang L, Wang F, Gershwin ME. Human autoimmune diseases: a comprehensive update. J Intern Med. 2015;278(4):369-395. doi: 10.1111/joim.12395
- Hunter TM, Boytsov NN, Zhang X, Schroeder K, Michaud K, Araujo AB. Prevalence of rheumatoid arthritis in the United States adult population in healthcare claims databases, 2004-2014. Rheumatol Int. 2017;37(9):1551-1557. doi: 10.1007/s00296-017-3726-1
- Baechler EC, Batliwalla FM, Karypis G, et al. Interferon-inducible gene expression signature in peripheral blood cells patients with severe lupus. Proc Natl Acad Sci U S A. 2003;100(5):2610-2615. doi: 10.1073/pnas.0337679100
- Chung IM, Ketharnathan S, Thiruvengadam M, Rajakumar G. Rheumatoid arthritis: the stride from research to clinical practice. Int J Mol Sci. 2016;17(6):900. doi: 10.3390/ijms17060900
- Dakwar E, Reddy J, Vale FL, Uribe JS. A review of the pathogenesis of ankylosing spondylitis. Neurosurg Focus. 2008;24(1):E2. doi: 10.3171/FOC/2008/24/1/E2
- Chen B, Li J, He C, et al. Role of HLA-B27 in the pathogenesis of anlkylosing spondylitis. Mol Med Rep. 2017;15(4):1943-1951. doi: 10.3892/mmr.2017.6248
- Levering WHBM, Wind H, Sintnicolaas K, Hooijkaas H, Gratama JW. Flow cytometric HLAB27 screening: cross-reactivity patterns of commercially available anti-HLA-B27 monoclonal antibodies with other HLA-B antigens. Cytometry B Clin Cytom. 2003;54(1):28-38. doi: 10.1002/cyto.b.10022