-
抗体試薬
- フローサイトメトリー用試薬
-
ウェスタンブロッティング抗体試薬
- イムノアッセイ試薬
-
シングルセル試薬
- BD® OMICS-Guard Sample Preservation Buffer
- BD® OMICS-One Protein Panels
- BD® AbSeq Assay
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ ATAC-Seq Assays
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Accessory Kits
- BD® OMICS-One Immune Profiler Protein Panel
- BD OMICS-One™ WTA Next Assay
-
細胞機能評価のための試薬
-
顕微鏡・イメージング用試薬
-
細胞調製・分離試薬
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location site or be switched to your location?

樹状細胞(DC)
樹状細胞(DC)は、自然免疫系と適応免疫系との橋渡しとして機能し、さまざまな造血細胞種に作用しています。DCはリンパ・骨髄性造血により生じ、骨髄に由来します。DCは、病原体を認識できることから自然免疫細胞であるとされていますが、主要組織適合遺伝子複合体(MHC)タンパク質の存在下で抗原を処理して提示し、ナイーブT細胞を発動させて脅威に対抗することもできます。3種類以上のDC(形質細胞様DC[pDC]、骨髄/通常型DC[cDC])が知られています1。DCは腫瘍微小環境において重要な役割を果たしています2。がん・慢性感染症・自己免疫疾患に対する免疫療法薬の開発や移植免疫寛容の導入にDCを利用することに大きな関心が寄せられています。BDは、マルチカラーフローサイトメトリーによるDCとそのさまざまなサブセットの濃縮・ソーティング・解析を可能にする機器・試薬製品ラインを拡大し続けます。
Biology of dendritic cells
DCは、自然免疫系と適応免疫系との橋渡しとして機能し、さまざまな造血細胞種に作用しています3-5。DCは強力に抗原を感知する抗原提示細胞(プロフェッショナルAPC)であり、自己抗原に対する耐性を守りながら外来抗原に対する一次免疫応答を引き起こす独自の能力を持ちます6。DCは、免疫応答の特異性・大きさ・極性の決定を導きます。
樹状細胞の成熟
未熟DCは骨髄中の前駆細胞から生じ、皮膚・肺・腸を含む全身のほぼすべてのリンパ組織および非リンパ組織に移動します7,8。共通DC前駆細胞から成熟DCへの分化経路には、さまざまな転写因子、シグナル伝達分子、増殖因子、サイトカイン、ケモカイン、接着受容体が関与しているとされています3,9,10。また未熟DCは、Toll様受容体(TLR)やC型レクチン受容体(CLR)をはじめとする多種多様な細胞表面のパターン認識受容体(PRR)を介して、自分と同じ環境に存在する損傷関連分子パターン(DAMP)や病原体関連分子パターン(PAMP)を識別することによりさらなる成熟シグナルを受け取って処理します3,12。このように損傷細胞や病原体を感知することで、DCは監視機能を果たし、身体の完全性を維持しています。
成熟組織DCはその表面に存在するケモカイン受容体や接着分子のプロファイルを微小環境信号に従って変化させ、走化性シグナルを受け取ると二次リンパ器官に戻ります。リンパ組織内では、そこに常在している未熟DCや他の場所からやってきた非常在DCがさらに刺激を受けて、分化を経て成熟機能性DCになることがあります。成熟DCは、自己MHC抗原の存在下で抗原を処理し、ナイーブCD4陽性T細胞やCD8陽性T細胞に提示するという高度な能力を持っています。これにより、外来抗原に対する一次免疫応答、または自己抗原に対する潜在的T細胞応答の下方制御のいずれかが引き起こされます。成熟DCは、その表面に存在する、ペプチドが結合した主要組織適合遺伝子複合体(MHC)抗原、共刺激性受容体(または共抑制性受容体)、リガンド(CD80やCD86など)の発現を亢進し、IL-6やIL-12p70などのサイトカインやインターフェロン(IFN)を放出することで、ナイーブT細胞を刺激します12,13。T細胞は成熟DCの性質をさらに調整することができます。反応したT細胞は、DCを相互に、例えばCD40とCD40Lの相互作用を介して、あるいはT細胞由来サイトカイン(IL-4やIFN-γなど)によって制御することがあります。このように、T細胞はプロフェッショナルAPCにさらに指示を出すことがあり、その結果、さまざまなT細胞依存性免疫や耐性が促進されることがあります。
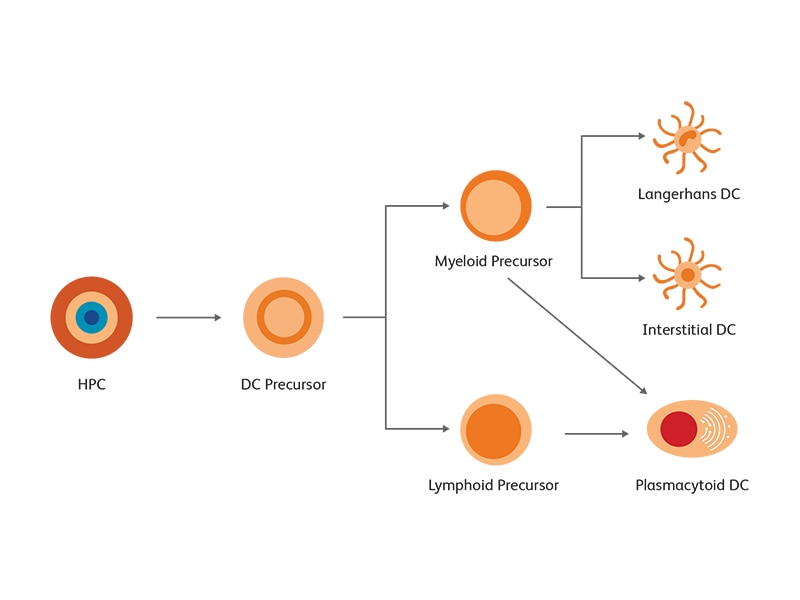
Multifunctional roles of dendritic cells
DCは強力に免疫応答を引き起こすだけなく、続いて起こる免疫応答の種類・大きさ・持続期間を決定づけるうえで重要な制御的役割を果たしています1,4,10,11。DCはこれを、細胞表面のリガンドや受容体の差次的発現や、プロファイルの異なるサイトカイン・ケモカイン・炎症性メディエーターの分泌によって遂行します。例えば、IL-12p70を放出するDCは、1型CD4陽性ヘルパーT細胞(Th1)や細胞溶解性CD8陽性T細胞を優先的に促進すると考えられます。その他の種類のDCは、Th2、Th9、Th17、Th22、濾胞性ヘルパーT(Tfh)細胞、あるいは制御性T(Treg)細胞に特有の、T細胞依存性の液性免疫応答または細胞性免疫応答を促進すると考えられます。どのDCがこれらの種類のT細胞依存性免疫応答をどのように指揮しているのかという問題は依然として存在しており、現在さかんに研究がなされています。
一部の試験からはDCの成熟度が重要であると指摘されていますが、別の試験からは病原体の種類や関与している組織部位の影響が大きいと指摘されています。これらはすべて、慎重な検討を要する非常に重要な要因です。DC経路内には大きな機能的可塑性があることから、真実は上記の指摘の間のいずれかに存在すると考えられます15,16,17。DCが作り出している自然免疫系と適応免疫系との不可欠なつながりの重要性も認知されつつあります。DCは危険信号を受けて成熟することで増殖性T細胞応答を誘発できるようになるだけでなく、マクロファージ、ナチュラルキラー(NK)細胞、ナチュラルキラーT細胞(NKT細胞)、顆粒球、そしてマスト細胞を活性化することによって、体内に侵入した感染性病原体に対する自然応答も惹起します15。形質細胞様DC(pDC)が主要なIFNの源であり、特定のウイルスに反応して素早くIFNを分泌するという発見9は、DCが自然免疫応答と適応免疫応答の両方において果たしている多機能的役割の重要な例の1つです。
樹状細胞の多様性
発生源、形態、局在性、成熟状態、表現型、機能などが異なる多くの種類の前駆DC・未熟DC・成熟DC(例:ランゲルハンス細胞、真皮DC、間質性DC、血中DC)10,15がこれまでに報告されています。細胞表面の表現型は動物種間で一部異なるものの、一般的に認められている形質細胞様DC(pDC)と、骨髄DC(mDC)、別名古典的/通常型DC(cDC)、という2種類のDCが、細胞系譜が異なると思われるヒトモデル系とマウスモデル系において報告されています1。pDCは非常に高いIFN産生能を持ちますが、mDCほど効率的には抗原を提示しないと考えられます1,3。ヒトpDCはCD123とCD304の共発現によって識別することができますが、マウスpDCsはCD45R/B220とLy-6Cを発現します1,9,10。さらに、2つの主要なクラスのmDCがヒトおよびマウスにおいて分類されており、IFN制御因子4かIRF-8のいずれかを代わりに発現することによって識別されます(それぞれIRF4陽性DCとIRF-8陽性DC)11。ヒトのIRF4陽性DCはその特徴としてCD1cを発現しますが、マウスのIRF4陽性DCはCD4(リンパ系DC)かCD11b(遊走性DC)のいずれかを発現します。いずれの動物種に由来するIRF4陽性DCも、CD172aとSirp-αを共発現し、抗原をナイーブCD4陽性T細胞に効率良く提示することができます。逆に、ヒトIRF8陽性DCは通常、CD141を発現し、マウスIRF8陽性DCはCD8a(リンパ系DC)またはCD103(遊走性DC)のいずれかを発現します。すべてのサブセットがXCR1ケモカイン受容体であるCD370/Clec9aを発現し、抗原をCD4陽性T細胞とCD8陽性T細胞に提示することができます。ヒトおよびマウスのランゲルハンス細胞(LC)は同様に、CD207/ランゲリン、CD326/EpCAM、CD324/E-カドヘリンなど、共通するいくつかの特徴的なマーカーを共発現します3,10。また、両動物種の真皮や腸に存在するDCサブセットも報告されています3。ヒトおよびマウスのDCサブセットの要約については、下の図をご参照ください。
ヒトDCサブセットとマウスDCサブセットの機能性
ヒトDCサブセット |
マウスDCサブセット |
頻度 |
存在する場所 |
刺激後のサイトカイン産生* |
pDC |
pDC |
末梢血単核細胞(PBMC)の約1% |
ヒト血液 |
IFN-I+, IFN-III(IFN-λ)+ |
CD1c+ DC |
CD4+ またはCD11b+ DC |
PBMCの約1% |
ヒト血液 |
IL-1β+、IL-6+、IL-8+ |
CD141+ DC |
CD8+ またはCD103+ DC |
PBMCの0.03% |
ヒトリンパ節・扁桃・脾臓・骨髄 |
IFN-I+、IFN-III(IFN-λ)+ |
LC |
LC |
表皮細胞の3~5% |
ヒト重層扁平上皮 |
IL-15+ |
炎症性DC |
炎症性DC |
|
炎症部位 |
IL-1β+、IL-6+ |
*サイトカイン産生は、使用した刺激物質、刺激条件、あるいは細胞の生理学的状態によって異なる場合があります。
**TNF は通常、TLR8刺激後のヒトCD141陽性DCにより産生されることはありません。
同じDCのクラスの1つである炎症性DCは、単球由来と考えられており、環境刺激によって生じてDCの特徴と機能を引き継ぐと考えられています3。明らかな点として、各種のDCサブセットと、それらのTLR・CLR・CD1分子・ケモカイン受容体発現プロファイルおよびサイトカイン分泌パターンについて、機能的に関連している特定の分子における動物種間の誘発性の相違や類似点が報告されています3。因子の組合せ(DCサブセットと成熟状態など)が、結果的に生じるT細胞応答に影響を及ぼすため、機能試験を組み合わせた詳細な表現型解析が、生理学的な側面だけでなく病理学的な側面からも複雑なDC生物学をさらに深く解明するうえで有用な方法の1つとなるでしょう。
References
- Palucka K and Banchereau J. Cancer immunotherapy via dendritic cells. Nat Rev Cancer. 2012;12(4):265-277. doi: 10.1038/nrc3258
- Janco JMT, Lamichhane P, Karyampudi L, Knutson K. Tumor-infiltrating dendritic cells in cancer pathogenesis. J Immunol. 2015;194(7):2985-2991. doi: 10.4049/jimmunol.1403134
- Merad M, Sathe P, Helft J, Miller J, Mortha A. The dendritic cell lineage: ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting. Annu Rev Immunol. 2013;31:563-604. doi: 10.1146/annurev-immunol-020711-074950
- Schraml BU, Reis e Sousa C. Defining dendritic cells. Curr Opin Immunol. 2015;32:13-20. doi: 10.1016/j.coi.2014.11.001
- Collin M, McGovern N, Haniffa M. Human dendritic cell subsets. Immunology. 2013;140(1):22-30. doi: 10.1111/imm.12117
- O'Keeffe M, Mok WH, Radford KJ. Human dendritic cell subsets and function in health and disease. Cell Mol Life Sci. 2015;72(22):4309-4325. doi: 10.1007/s00018-015-2005-0
- Apostolopoulos V, Thalhammer T, Tzakos AG, Stojanovska L. Targeting antigens to dendritic cell receptors for vaccine development. J Drug Deliv. 2013;2013:869718. doi: 10.1155/2013/869718
- Cohn L, Delamarre L. Dendritic cell-targeted vaccines. Front Immunol. 2014;5:255. doi: 10.3389/fimmu.2014.00255
- Delamarre L, Mellman I. Harnessing dendritic cells for immunotherapy. Sem Immunol. 2011;23(1):2-11. doi: 10.1016/j.smim.2011.02.001
- Breton G, Lee J, Liu K, Nussenzweig MC. Defining human dendritic cell progenitors by multiparametric flow cytometry. Nat Protoc.2015;10(9):1407-1422. doi: 10.1038/nprot.2015.092
- Poltorak MP, Schraml BU. Fate mapping of dendritic cells. Front Immunol. 2015;6:199. doi: 10.3389/fimmu.2015.00199
- Swiecki M, Colonna M. The multifaceted biology of plasmacytoid dendritic cells. Nat Rev Immunol. 2015;15(8):471-485. doi: 10.1038/nri3865
- Murphy TL, Grajales-Reyes GE, Wu X, et al. Transcriptional control of dendritic cell development. Annu Rev Immunol. 2016;34:93-119. doi: 10.1146/annurev-immunol-032713-120204
- Durand M, Segura E. The known unknowns of the human dendritic cell network. Front Immunol. 2015;6:129. doi: 10.3389/fimmu.2015.00129
- Dutertre CA, Wang LF, Ginhoux F. Aligning bona fide dendritic cell populations across species. Cell Immunol. 2014;291(1-2):3-10. doi: 10.1016/j.cellimm.2014.08.006
- Schlitzer A, Ginhoux F. Organization of the mouse and human DC network. Curr Opin Immunol. 2014;26:90-99. doi: 10.1016/j.coi.2013.11.002
- Reis e Sousa C. Activation of dendritic cells: translating innate into adaptive immunity. Curr Opin Immunol. 2004;16(1):21-25. doi: 10.1016/j.coi.2003.11.007.
Human dendritic cells
ヒト樹状細胞(DC)サブセットは、フローサイトメトリーにより、多数の細胞表面マーカーや細胞内マーカーを用いて特性を明らかにすることができます。
以下の末梢血の例は、使用可能なBD OptiBuild™カスタム試薬に基づくDCサブセットの同定を示したものです。
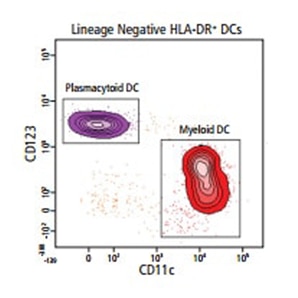
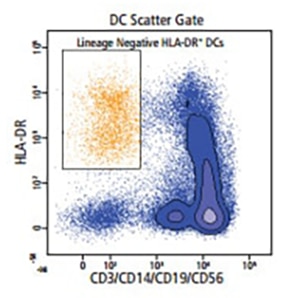
下の表に、各種のヒトDCサブセットの表現型特性評価において重要となるマーカーを示します。細胞内マーカーは太字で示します。BD Life Sciencesは、ほとんどのマーカーに特異性を示す幅広い抗体試薬製品ラインを複数のフォーマットで取り揃えており、柔軟なパネル設計や下流解析が可能となります。
ヒトDCサブセットはすべて、lineage– (CD3– CD19– CD20– CD56– CD141) and CD45+ MHCII (HLA-DR)+ CD11c+/-2 と同定されています。
DCサブセット |
重要なマーカー |
|||
一次マーカー |
追加的な陽性マーカー |
追加的な陰性マーカー |
転写因子 |
|
形質細胞様DC |
CD123(IL-3Rα)high |
CD2±、CD4+、CD45RA+ |
CD1a–、CD1c(BDCA1)– |
IRF7+、IRF8+ |
CD1c+ 骨髄DC |
CD1c(BDCA1)+ |
CD4+、CD13+、CD26low、CD33+ |
CD1a–、CD16(FcγRIII)– |
IRF4+ |
CD141+ 骨髄DC |
CD141(BDCA3)high |
CD4+、CD11blow |
CD1a–、CD1c(BDCA1)–、CD16(FcγRIII)– |
IRF8+ |
ランゲルハンス細胞 |
CD207(ランゲリン)+ |
CD1ahigh、CD1c(BDCA1)+ |
CD304(ニューロピリン-1/BDCA4)– |
|
CD1a+ 真皮DC |
CD1a+ |
CD1c(BDCA1)+ |
CD207(ランゲリン)– |
|
CD14+ 真皮DC |
CD14+ |
CD1c(BDCA1)+ |
CD1a– |
|
炎症性DC (単球由来DC) |
CD16(FcγRIII)+ |
CD172a(Sirp-α)+ |
CD207(ランゲリン)– |
|
1CD14 は、CD14陽性真皮DCと炎症性DCを除くすべてのDCサブセットにおいて発現陰性または低発現です。
2CD11c は、形質細胞様DCを除くすべてのDCサブセットにおいて陽性です。形質細胞様DCは低発現または発現陰性と報告されています。
TLR7、8、9 はエンドソームであり、細胞内染色が必要です。
Mouse dendritic cells
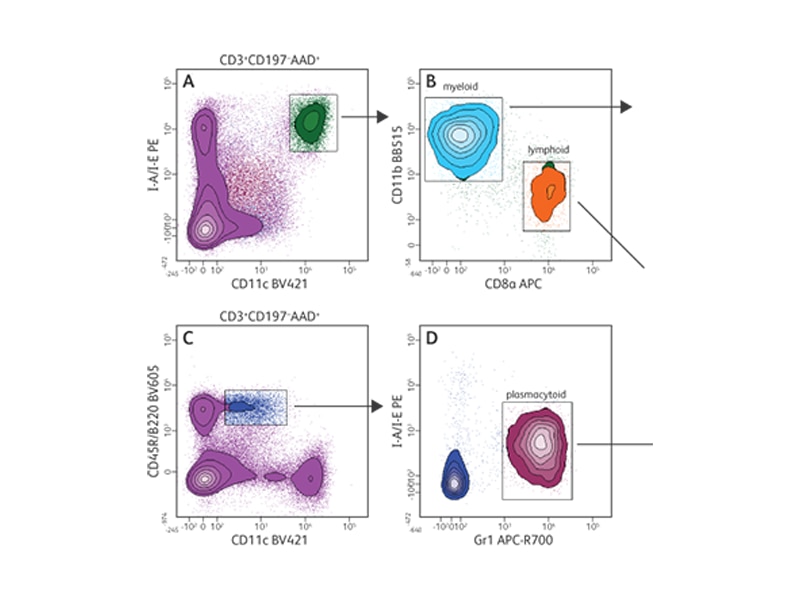
マウス樹状細胞(DC)サブセットは、フローサイトメトリーにより、多数の細胞表面マーカーや細胞内マーカーを用いて特性を明らかにすることができます。
以下のマウス脾臓の例は、使用可能なBD OptiBuild™カスタム試薬に基づくDCサブセットの同定を示したものです。
マウス樹状細胞サブセットの免疫表現型解析。マウス脾臓におけるマウスDCの3大サブセット(骨髄DC、リンパ系DC、形質細胞様DC)の10色免疫表現型解析。BALB/cマウス脾臓を酵素的に分解し、抗体カクテル(BD OptiBuild™試薬Sirpα BV650とClec12A BV786を含有)で染色して、BD FACSCelesta™フローサイトメーターBlue/Violet/Red(BVR)レーザー構成で解析しました。
これらの細胞をまず、CD3、CD19、7-AAD陰性細胞上でゲーティングしました(データの表示なし)。A-D。ゲーティング方法:I-A/I-EhighCD11chigh通常型樹状細胞(DC)さらにCD11b陽性mDCとCD8陽性lDCに分類しました。I-A/I-ElowCD11clow B220陽性Gr1陽性細胞はpDCとしました。結果:追加的なマーカーであるCD4、CD172a(Sirpα)、CD371(Clec12A)の差次的発現を、それぞれmDC(E、F、G)、lDC(H、I、J)、pDC(K、L、M)サブセット内でさらに解析しました。蛍光マイナスワン(FMO)コントロールに基づいてゲートを描出しました。
下の表に、各種のマウスDCサブセットの表現型特性評価において重要となるマーカーを示します。細胞内マーカーは太字で示します。BD Life Sciencesは、ほとんどのマーカーに特異性を示す幅広い抗体試薬製品ラインを複数のフォーマットで取り揃えており、柔軟なパネル設計や下流解析が可能となります。
マウスDCマーカーは、lineage – (CD3– CD19– CD49b– or NK1.1– CD14–) and CD45+ MHCII+ CD11c+と同定されています。
DCサブセット |
重要なマーカー |
|||
一次マーカー |
追加的な陽性マーカー |
追加的な陰性マーカー |
転写因子 |
|
形質細胞様DC(pDC) |
CD45R(B220)+ |
CD4+、CD26+ |
CD11– |
IRF7+、IRF8+ |
CD4+CD11b+ |
CD4+ |
CD24+、CD26+ |
CD36– |
IRF4+ |
CD4–CD11b+ |
CD11b+ |
CD24±、CD26+ |
CD36– |
IRF4+ |
CD8a+通常型 |
CD8a+ |
CD1d1+、CD24+、CD26+ |
CD45R(B220)– |
IRF8+ |
CD103+通常型 |
CD103+ |
CD1d1+、CD24+ |
CD45R(B220)– |
IRF8+ |
ランゲルハンス細胞 |
CD207(ランゲリン)+ |
CD24+ |
CD8a–、CD26–、CD36– |
|
CD207+ 真皮DC |
CD207(ランゲリン)+ |
CD103± |
CD45R(B220)– |
|
CD207– 真皮DC |
CD207(ランゲリン)– |
CD172a(Sirp-α)+ |
CD45R(B220)– |
|
炎症性DC |
CD64(FcγRI)+ |
CD209a(DC-SIGN)+ |
CD8a–、CD45R(B220)–、CD103– |
|
Isolation of dendritic cells
研究方法によっては、分離した樹状細胞(DC)集団を使用してさらなる特性評価、培養、機能試験を行う必要があります。血中単核細胞のわずか0.1~1%を占めるに過ぎないこれらの非常に希少な細胞種を分離するのは、これまで困難とされてきました3。フローサイトメトリーや磁気ビーズ分離といった技術の進歩により、DCの分離がこれまでより容易に行えるようになりました。フローサイトメトリーを用いたセルソーティングにより、シングルセルを分離してさらに解析することが可能になります。
樹状細胞集団
分離したDC集団は、多くの場合、機能アッセイ(T細胞との共培養など)の実施やその他の下流の用途に用いられます。BD Biosciencesは、ヒトDCもマウスDCも確実に分離するための方法をご提供しています。
BD IMag™細胞分離システムは、シンプルながらも効果の高い直接的な磁気技術に基づいています。例えば、DCの正・負の選択は、さまざまなBD IMag™粒子フォーマットの細胞表面結合抗体から選択して行うことができます。少数の短いステップで非DC集団に負の選択を用いることのできる、使いやすいヒト・マウスDC濃縮セットもあります。
高い純度と細胞回収率を実現し、マルチマーカー表現型によって定義される細胞の分離に最適なフローサイトメトリーソーティングは、これらの極めて希少な細胞を分離するのに非常に効果的な方法です。これまで多くの研究者がBD FACSAria™セルソーターを用いて特定のDC集団の分離を行ってきました5。
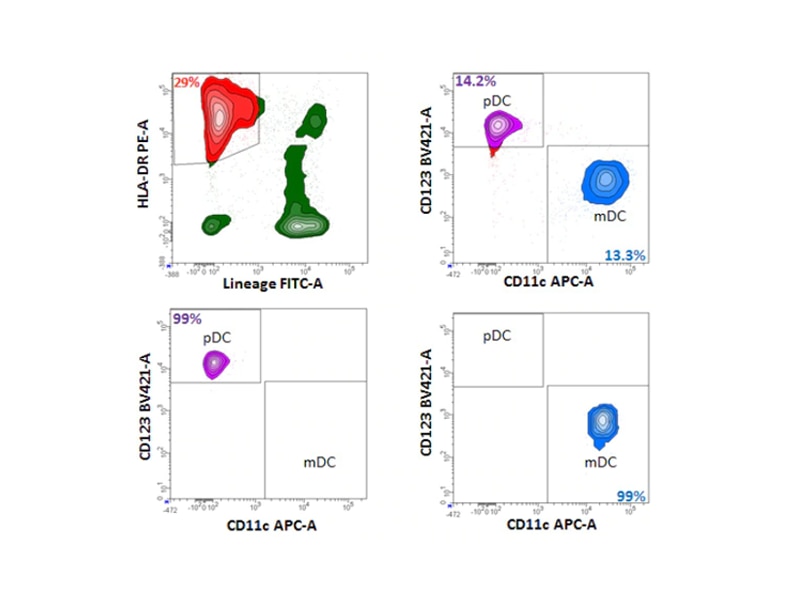
ヒトPBMC由来のpDCとmDCの分離
形質細胞様DC(pDC)と骨髄DC(mDC)は、Lin– HLA-DR+ CD123+ CD11c–(pDC)と、Lin– HLA–DR+ CD123– CD11c+(mDC)の表現型に基づいてヒト末梢血から分離することができます。下に示す例では、末梢血単核細胞(PBMC)にBD IMag™ヒト樹状細胞濃縮セット(カタログ No. 558420)を使用して濃縮前のステップを行い、赤血球・血小板・末梢白血球(DC以外のもの)に負の選択を適用することで、細胞表面の染色とソーティングのための、DCが豊富なサンプルを得ることができました。
これらの細胞を、細胞系譜カクテルFITC、CD123 BV421、HLA-DR PE、CD11c APCで染色しました。生死判別色素FVS780を用いて死細胞を取り除きました。BD FACSAria™フローサイトメーターを用いてセルソーティングを行いました。BD Imag™粒子型濃縮とフローサイトメトリーソーティングの併用は、所要時間を短縮できる便利なワークフローで、通常はヒト血液中に低頻度にしか存在しないDC集団を高い純度で作製することができます。
BDのアプリケーションスペシャリストが、現地訪問または電話にて、お客様のソーティングをサポートするためのアドバイスをさせていただきます。詳細については、当社のSupport pageをご覧ください。
BD FACSMelody™、 BD FACSAria™ III、 BD FACSAria™ Fusion セルソーターなどのBDフローサイトメトリープラットフォームは、シングルセルをさまざまなプレートにソーティングするプロセスをサポートします。シングルセルソーティングは自動捕集装置によって可能となり、その有用性はインデックスソーティング機能を組み合わせることで高まります。この機能は、それぞれのソーティングイベントのフローサイトメトリーデータ(例:マーカーの表現型)やソートロケーション(ソートコレクションデバイスのX座標とY座標)を記録するというものです。こうして、ソーティング後のアッセイの結果(DNAやRNAの配列解析も含まれる場合があります)を正確に追跡して、特定細胞のフロー特性に遡ることができます。
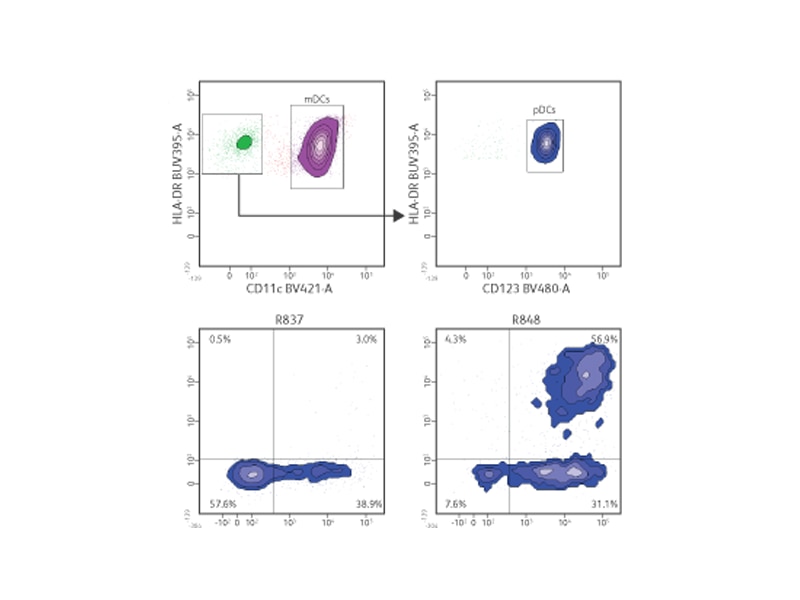
サイトカインの検出
樹状細胞(DC)によって分泌されるサイトカインの種類と量を測定すれば、DC応答の性質と大きさがわかります。分泌される因子(サイトカインやケモカインなど)を測定するためにマルチプレックスアッセイが使用されることが増えてきています。
動的な幅広い蛍光検出とマルチプレックス測定は、従来の酵素結合免疫測定(ELISA)法よりも少量のサンプル、より少ないサンプル希釈、そして大幅に短縮された時間で、未知の手法の価値を確立することができます。
BD® CBA 製品ラインには、さまざまな可溶性因子(サイトカインやケモカインなどの分泌タンパク質など)、排出・放出された細胞表面マーカー(例:sCD14)、細胞シグナル伝達分子(細胞溶解物中のリン酸化タンパク質など)を測定するためのアッセイが含まれます。
Intracellular detection of cytokines
サイトカインは、タンパク質輸送阻害薬で分泌を阻害することにより、サイトカインを産生している細胞内で検出することができます。そのため、活性化細胞集団によるサイトカイン産生が、大量のサイトカインを産生している少数の細胞によるものなのか、あるいは細胞当たりのサイトカイン産生量が少量である大きな細胞集団によるものなのかを識別することが可能です。
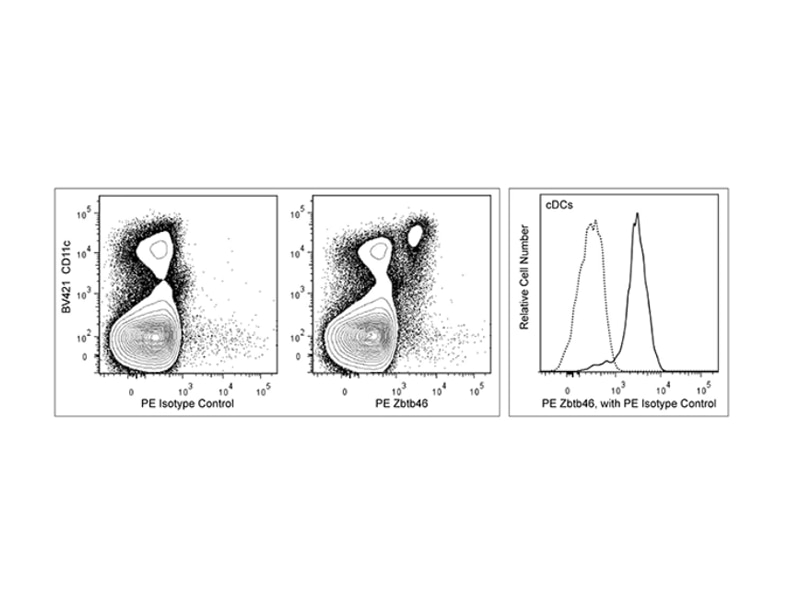
転写因子とその他の細胞内タンパク質
初期発生からエフェクター機能を持つ成熟DCに至るまでのDCの生理学的特性の解析により、発生状態、細胞活性化、あるいはその他の機能的特性に伴う細胞内変化が明らかとなりました。
BDは、これらの細胞内分子の解析を可能にし、DCの生物学的機能を制御する相互に接続している経路の解読をサポートするさまざまなソリューションを提供しています。
転写因子の検出
BDは、DCに関連する、フローサイトメトリー用にバリデートされた転写因子抗体をいくつか取り揃えています。例えばマウスでは、通常型DCとその前駆体にZbtb46が発現しますが、pDCでは発現しません。一方、pDCの発生や機能にはSpi-Bが必要です2。
リン酸化タンパク質の検出
BD Phosflow™抗体は、フローサイトメトリー検出用にバリデートされたモノクローナルホスホエピトープ特異的抗体です。BD Phosflow™透過処理緩衝液IIIは、ほとんどのBD Phosflow™抗体に推奨されますが、このほかにも、例えば細胞表面染色や亜集団解析に対応した透過処理緩衝液があります。
pDCの発生にそれぞれに異なった作用をもたらすpSTAT3やpSTAT5のための試薬など、DCの発生と活性化に関与するシグナル伝達経路の解析に必要な、多くの特異性を示すBD Phosflow™抗体を取り揃えています。BD Phosflow™システムはこれまで、リン酸化タンパク質(in vitroでのpDCのウイルス感染後のpSykなど3)を測定するのに用いられてきました。そして、自然免疫系と適応免疫系に関する細胞シグナル伝達研究に広く使用されています。
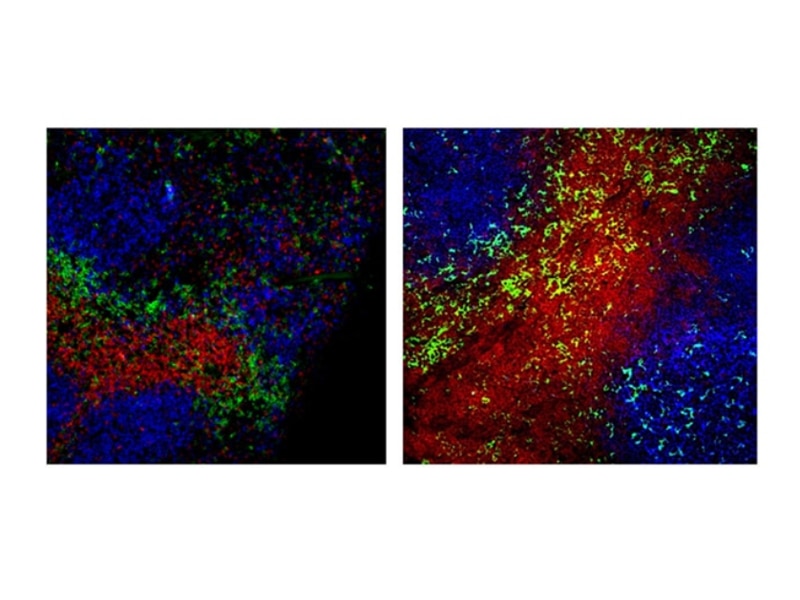
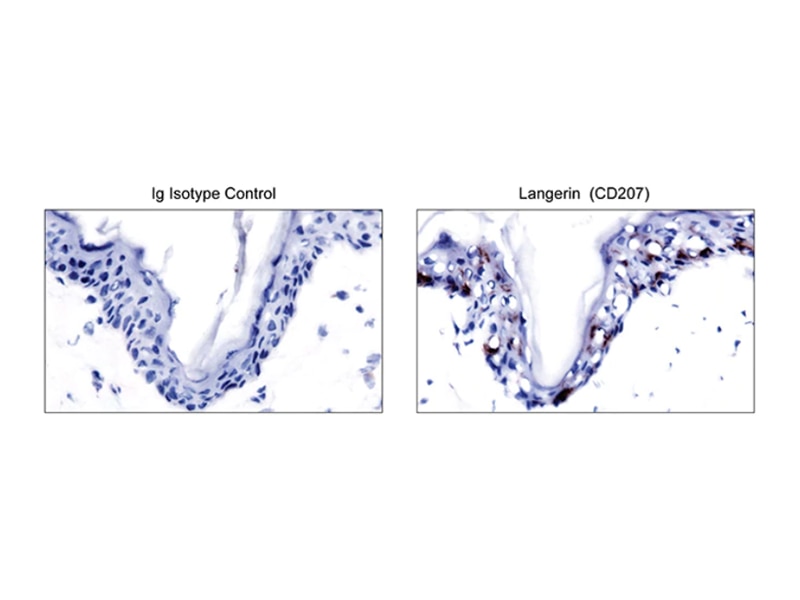
Immunofluorescence and immunohistochemistry
DCの形態と細胞内局在性
モノクローナル抗体と蛍光イメージングの併用により、組織内でのDCの同定が可能となり、in vitroにおけるDC生物学の機構的側面が明らかになります。
新しい高輝度・高光安定性蛍光色素に直接結合しているBDのモノクローナル抗体(BD Horizon Brilliant Violet™ 421(BV421)、BD Horizon™ Bv480など)は、従来の3~4色顕微鏡法を超えるマルチカラーイメージングを可能にします。
References
- Merad M, Sathe P, Helft J, Miller J, Mortha A. The dendritic cell lineage: ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting. Annu Rev Immunol. 2013;31:563-604. doi: 10.1146/annurev-immunol-020711-074950
- Collin M, McGovern N, Haniffa M. Human dendritic cell subsets. Immunology. 2013;140(1):22-30. doi: 10.1111/imm.12117
- Schraml BU, Reis e Sousa C. Defining dendritic cells. Curr Opin Immunol. 2015;32:13-20. doi: 10.1016/j.coi.2014.11.001
本製品は研究用です。診断や治療には使用できません。
Alexa FluorはLife Technologies Corporationの商標です。