-
抗体試薬
- フローサイトメトリー用試薬
-
ウェスタンブロッティング抗体試薬
- イムノアッセイ試薬
-
シングルセル試薬
- BD® OMICS-Guard Sample Preservation Buffer
- BD® OMICS-One Protein Panels
- BD® AbSeq Assay
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ ATAC-Seq Assays
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Accessory Kits
- BD® OMICS-One Immune Profiler Protein Panel
- BD OMICS-One™ WTA Next Assay
-
細胞機能評価のための試薬
-
顕微鏡・イメージング用試薬
-
細胞調製・分離試薬
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location site or be switched to your location?

免疫
正常な免疫システムは、自然免疫と獲得免疫、抗原を防御する能力、自己と非自己を区別する能力、免疫学的記憶、病原体排除後のシステムの抑制機構などにより機能します。 様々な種類の免疫細胞、それらの複雑な構造と精巧な制御により獲得免疫応答が惹起され、個体は恒常性を維持します。 フローサイトメトリーを使用すると、多数の免疫細胞の分析と特徴付け、サブタイプ特異的な細胞表面および細胞内マーカーの同定、治療後の免疫細胞減少の評価等を、正確かつ迅速に実施する事ができます。
*インタラクティブなHuman Cell Map*で免疫細胞のサブセットを探索します。
自然免疫応答と獲得免疫応答
自然免疫は病原体の攻撃に対する生体の主要かつ迅速な細胞応答です。その際、幅広い病原体で共通に保存されている構造が生体によって認識されます。この微生物に関連する分子パターンの認識は、表面受容体(Toll様受容体(TLR)とc型レクチン受容体(CLR))または細胞質受容体(TLR、ヌクレオチド結合オリゴマー化ドメイン(Nod)-ロイシンリッチリピート含有受容体(NLR)、RIG-I様受容体(RLR))等のパターン認識受容体(PRR)が介在します。PRRは2種類のリガンド、PAMP(病原体関連分子パターン)として知られる微生物病原体の保存構造と、DAMP(ダメージ関連分子パターン)として知られる、非感染性シグナルを認識します。このようなリガンドによるPRRの活性化は、免疫細胞の動員、シグナル伝達およびエフェクター分子(サイトカインや抗菌ペプチド)の分泌を誘導し、病原体または非感性性ストレスを緩和するための炎症反応を誘導する1。多くの場合、この最初の反応は、獲得免疫の初期応答の誘導の前提となります。
獲得免疫は、液性免疫がBリンパ球のIgG(またはB細胞受容体)、細胞性免疫がTリンパ球のT細胞受容体(TCR)を介して誘導されます。V領域、D領域、J領域のそれぞれの遺伝子セグメントの結合による体細胞組換えにより、Ig重鎖およびTCRβ鎖遺伝子による抗原認識は驚くべき多様性を獲得します。
自然免疫細胞
自然免疫系は、主にで単球、マクロファージ、顆粒球、樹状細胞(DC)構成されています。
単球
単球は血中最大の免疫細胞です。体内を循環しながら細菌や真菌に対する最前線を構成し、サイトカイン分泌を介して炎症を起こし、また、獲得免疫を誘導します。 単球は、CD14+ CD16-(ヒト)、CCR2+ Ly6Chi(マウス)の表現型を持つ古典的単球と、CD14lo CD16+(ヒト)、CCR2lo Ly6Clo(マウス)の表現型を持つ非古典的単球(patrolling monocytes)に分類されます2。
マクロファージ
マクロファージの特徴として、病原体の排除と免疫応答のプライミングをサポートする食作用能力があげられます。 また、マクロファージは代謝など必須の恒常性機能にも関与します3。更に、マクロファージは腫瘍の発生と進行にも深く関与しています。例えば腫瘍関連マクロファージ(TAM)は腫瘍細胞に対して免疫寛容を誘導する因子を分泌しています。それらは免疫腫瘍学として注目されており、特に、腫瘍微小環境(TME)に対する治療効果の評価については多くの検討がなされています。 マクロファージの2つの主要なタイプ(M1、M2)は、それぞれ異なる刺激によって分化すると考えられます。 M1マクロファージは炎症促進性であり、活性酸素(ROS)産生を伴う酸化状態を促進し、炎症性サイトカインおよびケモカイン(IL-1、IL-6、IL-12、TNF-α、CXCL9、CXCL10など)を分泌します。 M2マクロファージは免疫制御的であると考えられており、IL-10やTGF-βなどの抗炎症性因子を分泌します4。
顆粒球
顆粒球は細胞質顆粒が豊富な細胞であり、好塩基球5、好中球6、7、好中球8、肥満細胞が含まれます9。顆粒球細胞は、食作用(好中球)、寄生虫感染防御(好塩基球)、アレルギーへの関与(肥満細胞)など、さまざまな防御機構に関連しています。 また、免疫療法中の宿主応答を調節します。
樹状細胞
樹状細胞(DC)は、専門的な抗原提示細胞として、抗原を処理して適応免疫で重要なTおよびBリンパ球に抗原提示することにより、自然免疫と適応免疫を結び付けます。 樹状細胞には3つの主要なタイプが存在します:
- 形質細胞様樹状細胞(pDC)は、ウイルスおよび腫瘍細胞の認識を専門としています
- 1型古典的樹状細胞(cDC1)は細胞内病原体を認識し、CD8+T細胞およびTh1 CD4+T細胞応答を誘導します
- 2型古典的樹状細胞(cDC2)は、細胞内病原体、寄生虫、アレルゲン、真菌、細胞外細菌などへの暴露時、CD4+T細胞応答を誘導します
樹状細胞マーカーとして、CD11c、BDCA-1/2、CD123があげられます12、13。
trained immunityとは?
Trained immunityもしくは自然免疫記憶は、過去の感染に対する自然免疫細胞による宿主応答です14。この応答は獲得免疫における免疫学的ほど特異的ではありませんが、さまざまなタイプのパターン認識受容体(PRR)の関与を通じて、グラム陽性菌やグラム陰性菌などの幅広い病原体の認識が可能となります。
適応免疫細胞
Bリンパ球とTリンパ球は獲得免疫において重要であり、病原体に対して速くはないがより特異的な免疫応答を開始します15,16。
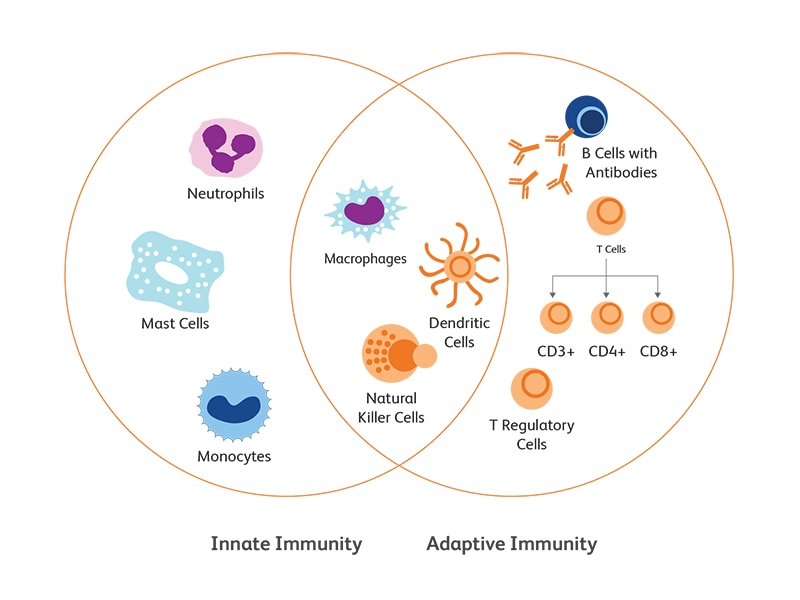
Tリンパ球
T細胞は骨髄で発生し、胸腺へと移動して成熟します。 T細胞の特徴的なマーカーとして、CD3およびT細胞受容体(TCR)があげられます。 それらは更に、細胞表面分子CD4(CD4+T細胞)とCD8(CD8+T細胞)の発現によって分類されます。表面マーカーと細胞内マーカーのフローサイトメトリースクリーニングにより、以下のようなT細胞サブセットを区別できます:Th1(CD3、CD4、IFN-γ、CCR5、CXCR3); Th2(CD3、CD4、CCR3、CCR4、CXCR4、IL-4、IL-10); Th17(CD3、CD4、CCR4、CCR6、TGFβRII、IL-17、CCL20); CD8 +細胞傷害性T細胞;T-regまたは制御性T細胞(CD3、CD4、FoxP3、CD25、CTLA4、OX40 / CD134、TGFβ、IL-10、IL-35)17。
B リンパ球
Bリンパ球またはB細胞は骨髄で成熟を開始します。 B細胞は、抗体産生を通じて体液性免疫に関与することはよく知られていますが、食作用や交差提示(cross-presentation)など他の重要な機能を有しています。 他のリンパ球と同様に、B細胞マーカーは成熟と分化により変化し、主要なものとしてCD19、CD27、CXCR4などが存在します18。
補体系
自然免疫と獲得免疫応答が開始されると、補体系を含む他の生体システムやプロセスからの影響を受けます。 補体系は、C反応性タンパク質(CRP)の関与する古典的補体経路、マンノース結合レクチン(MBL)が関連するレクチン経路、および代替経路(副経路)の3つの主要な経路からなる膜結合型および可溶性タンパク質因子のネットワークです。 補体カスケードの活性化は、最終的に細胞溶解につながります19
フローサイトメトリーを使用した細胞の免疫表現型解析表現検査
フローサイトメトリーは、表面マーカーと抗原の種類に基づいて目的の免疫細胞集団を特定するために広く使用されている重要な手法です。 この技術は、リンパ球サブセットの特定に加えて、まれな細胞タイプの分離、細胞内サイトカインの検出、および細胞の定量的分析も可能にします。 BD Biosciencesは、免疫学研究をサポートするために、研究用セルソーター、セルアナライザー、および包括的な蛍光色素ポートフォリオを提供しています。
参考文献
- Romo MR, Pérez-Martínez D, Ferrer CC. Innate immunity in vertebrates: an overview. Immunology. 2016;148(2):125-139. doi:10.1111/imm.12597
- Heung LJ. Monocytes and the host response to fungal pathogens. Front Cell Infect Microbiol. 2020;10:34. doi:10.3389/fcimb.2020.00034
- Mosser DM, Hamidzadeh K, Goncalves R. Macrophages and the maintenance of homeostasis [published online ahead of print, 2020 Sep 15]. Cell Mol Immunol. 2020;1-9. doi:10.1038/s41423-020-00541-3
- Petty AJ, Yang Y. Tumor-associated macrophages in hematologic malignancies: new insights and targeted therapies. Cells. 2019;8(12):1526. doi:10.3390/cells8121526
- Chirumbolo S, Bjørklund G, Sboarina A, Vella A. The role of basophils as innate immune regulatory cells in allergy and immunotherapy. Hum Vaccin Immunother. 2018;14(4):815-831. doi:10.1080/21645515.2017.1417711
- Liew PX, Kubes P. The neutrophil's role during health and disease. Physiol Rev. 2019;99(2):1223-1248. doi:10.1152/physrev.00012.2018
- Silvestre-Roig C, Fridlender ZG, Glogauer M, Scapini P. Neutrophil diversity in health and disease. Trends Immunol. 2019;40(7):565-583. doi:10.1016/j.it.2019.04.012
- Simon HU, Yousefi S, Germic N, et al. The cellular functions of eosinophils: Collegium Internationale Allergologicum (CIA) Update 2020. Int Arch Allergy Immunol. 2020;181(1):11-23. doi:10.1159/000504847
- Mukai K, Tsai M, Saito H, Galli SJ. Mast cells as sources of cytokines, chemokines, and growth factors. Immunol Rev. 2018;282(1):121-150. doi:10.1111/imr.12634
- Abel AM, Yang C, Thakar MS, Malarkannan S. Natural killer cells: development, maturation, and clinical utilization. Front Immunol. 2018;9:1869. doi:10.3389/fimmu.2018.01869
- Vivier E, Raulet DH, Moretta A, et al. Innate or adaptive immunity? The example of natural killer cells. Science. 2011;331(6013):44-49. doi:10.1126/science.1198687
- Collin M, Bigley V. Human dendritic cell subsets: an update. Immunology. 2018;154(1):3-20. doi:10.1111/imm.12888
- Takenaka MC, Quintana FJ. Tolerogenic dendritic cells. Semin Immunopathol. 2017;39(2):113-120. doi:10.1007/s00281-016-0587-8
- Netea MG, Joosten LA, Latz E, et al. Trained immunity: A program of innate immune memory in health and disease. Science. 2016;352(6284):aaf1098. doi:10.1126/science.aaf1098
- Netea MG, Schlitzer A, Placek K, Joosten LAB, Schultze JL. Innate and adaptive immune memory: an evolutionary continuum in the host's response to pathogens. Cell Host Microbe. 2019;25(1):13-26. doi:10.1016/j.chom.2018.12.006
- Flajnik MF. A cold-blooded view of adaptive immunity. Nat Rev Immunol. 2018;18(7):438-453. doi:10.1038/s41577-018-0003-9
- Mousset CM, Hobo W, Woestenenk R, Preijers F, Dolstra H, van der Waart AB. Comprehensive phenotyping of T cells using flow cytometry. Cytometry A. 2019;95(6):647-654. doi:10.1002/cyto.a.23724
- Martínez-Riaño A, Bovolenta ER, Mendoza P, et al. Antigen phagocytosis by B cells is required for a potent humoral response. EMBO Rep. 2018;19(9):e46016. doi:10.15252/embr.201846016
- Lubbers R, van Essen MF, van Kooten C, Trouw LA. Production of complement components by cells of the immune system. Clin Exp Immunol. 2017;188(2):183-194. doi:10.1111/cei.12952
研究用です。治療・診断には利用できません。