-
抗体試薬
- フローサイトメトリー用試薬
-
ウェスタンブロッティング抗体試薬
- イムノアッセイ試薬
-
シングルセル試薬
- BD® OMICS-Guard Sample Preservation Buffer
- BD® OMICS-One Protein Panels
- BD® AbSeq Assay
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ ATAC-Seq Assays
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Accessory Kits
- BD® OMICS-One Immune Profiler Protein Panel
- BD OMICS-One™ WTA Next Assay
-
細胞機能評価のための試薬
-
顕微鏡・イメージング用試薬
-
細胞調製・分離試薬
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location site or be switched to your location?

T細胞
Tリンパ球は、病原体の除去におけるTリンパ球の役割、免疫療法への応用、および調節不全とさまざまな疾患との関連についての理解が深まっているため、過去10年間で研究の最前線に立ってきました。重要な例は、ヒト免疫不全ウイルス(HIV)などの感染症や、後天性免疫不全症候群(AIDS)1などの重度の二次免疫不全によって媒介されるT細胞の老化に見られます。健康なヒトでは、成熟T細胞とT制御性細胞(Treg)が末梢免疫寛容の維持に役立ち、自己抗原に対する自己免疫を防ぎます。最近興味深いのは、PD-1やCTLA-4などのT細胞受容体を標的とする免疫チェックポイント阻害剤であり、腫瘍微小環境におけるT細胞の活性化と抗原を経験したT細胞の増殖を阻害しないことに成功しています2。この戦略は、黒色腫やその他の腫瘍の治療にうまく使用されています。抗CD19CAR-T細胞などのキメラ抗原受容体(CAR)-T細胞は、急性リンパ芽球性白血病などのB細胞悪性腫瘍に対して非常に成功しています(約93%の応答)2。フローサイトメトリーは、T細胞の免疫表現型検査と分析のための強力なツールを提供し、これらの各分野における知見を深めます。
T細胞の発生と分化
T細胞は骨髄で発生し、成熟するために胸腺に移動します。 T細胞の特徴的なマーカーは、T細胞受容体(TCR)とTCR複合体の遍在するメンバーであるCD3です。 それらはさらに、他の表面分子、CD4(CD4 +またはヘルパーT細胞)およびCD8(CD8 +または細胞傷害性T細胞)の発現によって2つの主要なタイプにサブセット化することができます。3
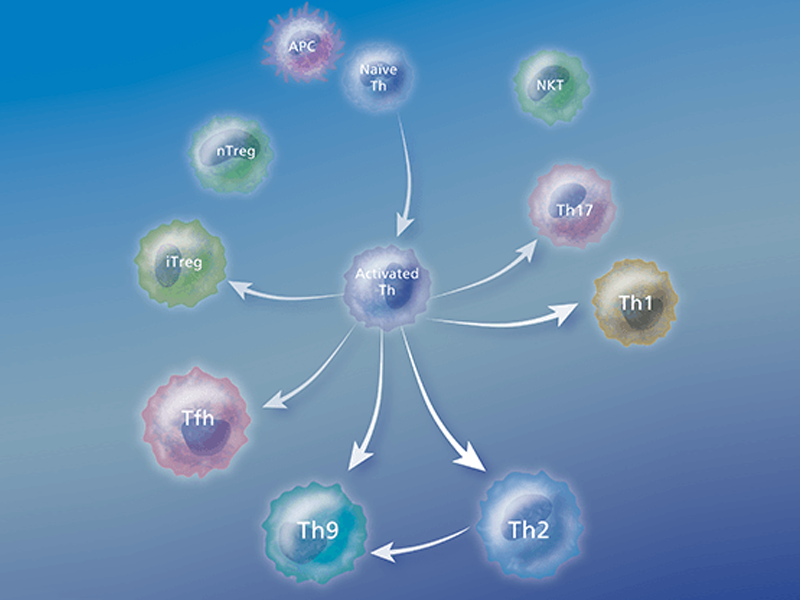
T細胞サブタイプ
ヘルパーT細胞
多彩な免疫反応を調節するのがヘルパーT細胞です。獲得免疫は、外来抗原への暴露後、後天的に形成され、高度な特異性と免疫記憶を特徴としています。なかでも、T細胞は獲得免疫の中枢司令塔であり、各々のサブセットが特徴的な機能を持つことが知られています。ヘルパーT細胞は、認識した抗原に応じて、異なる細胞集団を誘導あるいは活性化し免疫反応を調節します。
樹状細胞の抗原提示細胞(APC)による刺激を受けると、マクロファージとB細胞、抗原特異的CD4 + T細胞は、それらが膜上で発現または分泌するサイトカインとエフェクター分子、およびそれらの個別のエフェクター機能に関して特殊化されたエフェクター細胞に分化します。 いくつかのタイプのTh細胞が認識されています。
Th1 細胞
Th1細胞は、細胞性免疫を司り細胞内寄生細菌やウィルスに対する感染防御を行います。Th1細胞によりIFN-γやIL-2、LTαなどの炎症性サイトカインが放出されると、マクロファージや細胞障害性T細胞は活性化し、効率よく貪食する、病原微生物を破壊する、標的となる細胞を認識し殺傷するなどその役割を果たします。また、多発性硬化症やインスリン依存性糖尿病といった慢性炎症疾患は、Th1の関与が示唆されています。
Th2 細胞
Th2細胞は、 液性免疫を司り、細胞外寄生性病原体に対してアレルギー反応といったような生体防御を行います。Th2細胞のIL-4, IL-5, IL-6, IL-10やIL-13といったサイトカイン分泌をうけると、IL-4により形質細胞は抗原特異的な抗体産生を促され、抗体は病原微生物を捉える、IL-5 によって分化増殖した好酸球は顆粒タンパクの放出により寄生虫を傷害するなど、種々の細胞はその機能を発揮します。また、Th2細胞は、IL-9の供給源であると考えられてきましたが、近年IL-9とIL-10を分泌するTh9細胞が報告されています。Th9細胞は、TGF-β存在下でTh2細胞から分化、あるいは、IL-4及びTGF-β存在下でナイーブT細胞から分化し、喘息や組織の炎症に関与すると考えられています。
Th1, Th2細胞のバランス
Th1細胞がIFN-γを産生すると、これはマクロファージにTNFと毒性形態の酸素を産生するよう促し、ファゴソームとリソソーム内の微生物を破壊します。 一方、Th2細胞がIL-4およびIL-10を産生する場合、これらのサイトカインは、IFN-γによって活性化される微生物の死滅を阻止します。 Th1 / Th2の関係は、移植に関しても調査されています。 Th1応答は、急性移植片または移植片拒絶反応および移植片対宿主(GVHD)疾患のほとんどの形態に関係しているが、Th2応答は、保護または慢性拒絶反応のいずれかにさまざまに関連している。 ただし、クローン化されたTh1またはTh2細胞は、実験モデルで植皮を拒絶する同様の能力を持っており、Tr1 / Treg細胞は現在保護と寛容誘導に関与しています。
Th17 細胞
Th17細胞は、炎症と細胞外病原体に対する宿主防御に関与しています。 IL-17Aを産生するヘルパーT細胞のサブセットであるTh17細胞は、自己免疫組織損傷の誘導に重要な役割を果たすことが示されています。 それらは、IFN-γやIL-4などの古典的なTh1またはTh2サイトカインを産生しないため、Th1またはTh2細胞とは異なります。 それらは自己免疫のマウスモデルにおいて重要な役割を果たしており、ナイーブTヘルパー細胞からTh17細胞への分化経路にはTGF-βとIL-6の組み合わせが関与していることが示唆されています。 RORγtはTh17細胞の誘導に関与する重要な転写因子です。 一部のRORγt発現はIL-6またはTGF-βに応答して誘導されますが、Th17細胞の生成にはIL-6と同様にTGF-βが必要です。
Th17細胞は、TGF-βや IL-21によって増殖、主にIL-23 (p19/p40)によって維持され、IL-23 は IL-23受容体と結合し下流のSTAT3を活性化 、結果ROR-γの発現やIL-17Aの発現を促します.産生されたIL-17Aは、 マクロファージや繊維芽細胞など種々の細胞に作用し、TNFやIL-6などの様々な炎症性メディエータを誘導します。
一方でTregは、TGF-βにより誘導されるため、IL-6とTGF-βの相対的なバランスがTh17とTregの分化バランスを調節していると考えられ、免疫学的恒常性の維持、自己免疫疾患のメカニズムを理解するうえで重要とされています。
制御性T細胞
免疫反応に対する抑制をつかさどるのが、制御性T細胞です。2制御性T細胞(Treg)は、免疫恒常性を維持する上で重要な役割を果たします。 制御性T細胞は他のT細胞の機能を抑制して免疫反応を制限します。 制御性T細胞の数と機能の変化は、多発性硬化症、活動性関節リウマチ、1型糖尿病などのいくつかの自己免疫疾患に関係しています。 高レベルのTregは、肺がん、膵臓がん、乳がんなどの多くの悪性疾患で発見されています。 制御性T細胞はまた、抗腫瘍免疫反応を防ぎ、死亡率の増加につながる可能性があります。5
制御性T細胞(Treg)の免疫抑制の可能性に関する公表されたデータが蓄積されるにつれて、それらの潜在的なアプリケーションへの熱意が強まりました。 したがって、Tregの研究は非常に活発であり、新しい出版物がほぼ毎日出てきます。 今日、Tregの同定、分離、および特性評価に一般的に使用されるマーカーは、CD4、CD25、CD127、およびFoxP3です。 ただし、CD39、CD45RA、CTLA-4などの機能的に重要な新しいターゲットが急速に出現しています。
CD4 および CD8 T regs
これまでに、CD4およびCD8Tregの2つの主要なクラスのTregが特定されています。 CD4制御性T細胞は、CD25とFoxP3を構成的に発現する天然制御性T細胞(nTreg)と、いわゆる適応性または誘導性T細胞(iTreg)の2種類で構成されています。
Natural Tregsは、転写因子(および系統マーカー)FoxP3とともに高レベルのCD25を発現するCD4 +細胞として胸腺に由来します。 nTregは、CD4 + T細胞集団全体の約5〜10%を占め、Tリンパ球発達の単一陽性段階で最初に見られます。6, 7 それらは、自己抗原に対して比較的高いアビディティを持つポジティブに選択された胸腺細胞です。 Treg細胞に発達するシグナルは、T細胞受容体とMHCIIと胸腺間質に発現する自己ペプチドとの複合体との相互作用に由来すると考えられています。5 nTregは本質的にサイトカインに依存しません。
適応性または誘導性Tregは、単一陽性CD4細胞として胸腺に由来します。 それらは、同族の抗原およびTGF-β、IL-10、IL-4.8などの特殊な免疫調節性サイトカインの存在下で適切な抗原刺激を行った後、CD25およびFoxP3を発現するTreg(iTreg)に分化します。8
FoxP3は現在、Tregの最も受け入れられているマーカーですが9、FoxP3-Tregの集団が少ないという報告があります。 制御性T細胞のマーカーとしての転写因子FoxP3の発見により、科学者はTreg集団をより適切に定義できるようになり、CD127を含む追加のTregマーカーが発見されました。10
CD127 細胞
D127は、IL-7のレセプターの一部で、胸腺細胞、T細胞/B細胞の前駆体、成熟T細胞、単球およびいくつかの他のリンパ球性あるいは骨髄性細胞に発現しています。IL-7Rは、成熟T細胞の増殖や分化で重要な役割を果たしていることが報告されており、in vitroの研究において、T細胞の活性化に引き続きCD127の発現が低下することが示されています。現在では、FoxP3 はCD127 プロモーターに作用し、CD127の発現を低下させることに寄与していると考えられています。
References
- McCune JM. The dynamics of CD4+ T-cell depletion in HIV disease. Nature. 2001;410(6831):974-979. doi: 10.1038/35073648
- Todryk S, Jozwik A, de Hayilland J, Hester J. Emerging cellular therapies: T cells and beyond. Cells. 2019;8:284. doi:10.3390/cells8030284
- Mousset CM, Hobo W, Woestenenk R, Preijers F, Dolstra H, van der Waart AB. Comprehensive phenotyping of T cells using flow cytometry. Cytometry A. 2019;95(6):647-654. doi:10.1002/cyto.a.23724
- Qian J, Zhang N, Lin J, et al. Distinct pattern of Th17/Treg cells in pregnant women with a history of unexplained recurrent spontaneous abortion. Biosci Trends. 2018;12(2):157-167. doi:10.5582/bst.2018.01012
- Overacre-Delgoffe AE, Chikina M, Dadey RE, et al. Interferon-γ drives Treg fragility to promote anti-tumor immunity. Cell. 2017;169(6):1130-1141.e11. doi:10.1016/j.cell.2017.05.005
- Workman CJ, Szymczak-Workman AL, Collison LW, Pillai MR, Vignali DA. The development and function of regulatory T cells. Cell Mol Life Sci. 2009;66(16):2603-2622. doi:10.1007/s00018-009-0026-2
- Schiavon V, Duchez S, Branchtein M, et al. Microenvironment tailors nTreg structure and function. Proc Natl Acad Sci U S A. 2019;116(13):6298-6307. doi:10.1073/pnas.1812471116
- Liu M, Li S, Li MO. TGF-β control of adaptive immune tolerance: a break from Treg cells. Bioessays. 2018;40(11):e1800063. doi:10.1002/bies.201800063
- Lu L, Barbi J, Pan F. The regulation of immune tolerance by FOXP3. Nat Rev Immunol. 2017;17(11):703-717. doi:10.1038/nri.2017.75
- Rodríguez-Perea AL, Arcia ED, Rueda CM, Velilla PA. Phenotypical characterization of regulatory T cells in humans and rodents. Clin Exp Immunol. 2016;185(3):281-291. doi:10.1111/cei.12804
- Di Caro V, D'Anneo A, Phillips B, et al. Interleukin-7 matures suppressive CD127(+) forkhead box P3(FoxP3)(+) T cells into CD127(-) CD25(high) FoxP3(+) regulatory T cells. Clin Exp Immunol. 2011;165(1):60-76. doi: 10.1111/j.1365-2249.2011.04334.x
BD BiosciencesのT細胞解析のための試薬、キット
免疫系は、宿主と病原微生物の生存をかけた攻防の果てに進化した、多種多彩なメカニズムが集積する複雑な制御機構です。これらの研究では様々なアプリケーションが必要とされていますが、フローサイトメトリーでは、その表現型を多様な分化ステージで確認することができ、さらに、BD™ CBA(定量的測定試薬) やBD™ Phosflow(シグナル伝達解析試薬) では、細胞の様々なイベントや分子機構を解析することができます。また、ELISAやELISPOTなどの従来の手法を合わせて用いることでT細胞研究のさらなる深い知見を得ることができます。
下表は、T細胞研究に使われる手法を紹介しています。様々な手法を組み合わせて用いることで、より深い知見を得ることができます。BDはこれらの免疫研究に必要な試薬ポートフォリオを常に拡大しています。
| Tool/Technology | Flow Cytometry: Surface | Flow Cytometry: Introcellular | BD™ Cytometric Bead Array (CBA) | ELISPOT | ELISA | In Vivo Capture Assay |
|---|---|---|---|---|---|---|
| Molecules detected | Surface | Intracellular and surface | Secreted or intracellular | Secreted (in situ) | Secreted | Secreted (in vivo) |
| Multiparameter | Yes | Yes | Yes | No | No | No |
| Single cell/cell subset information | Yes | Yes | No | Frequencies, no subset information | No | No |
| Antigen-specific | Yes | Yes | Yes | Yes | Yes | Yes |
| Post-assay viability | Yes | No | Yes, for secreted molecules | No | Yes | Yes |
| Quantitation of protein | Possible* | Possible* | Yes | No | Yes | Yes |
| Instrumentation | Flow cytometer | Flow cytometer | Flow cytometer | ELISPOT reader | Spectrophotometer | Spectrophotometer |
*With a standard such as BD Quantibrite™ beads
イムノフェノタイピング: 表面抗原・細胞内解析
マルチカラーフローサイトメトリーを使用し、表面表現型とサイトカイン、転写因子、またはシグナル伝達分子の細胞内染色を組み合わせることで、特徴的なマーカーシグネチャに基づいて個々のT細胞サブセットを特定できます。 BDの高度な試薬システム、豊富なマーカー選択、豊富なサポートツールにより、研究者は表現型を簡素化し、個々のサンプルから得られる情報を最大化することができます。
フローサイトメトリーは表現型・機能解析に不可欠なツールです。分化の過程で、幼若なT前駆細胞は、 生存維持や分化に関わる様々な因子による制御をうけ、T細胞系列へと決定づけられます。T細胞サブセットは、CD4やCD8などの各マーカーの発現により同定することができます。 蛍光標識抗体を用いた基本的な解析では、個々の細胞における標的分子の発現レベルを多様な分化ステージを確認することができます。 また、CCR7, CD62Lや CD69といったようなマーカーも合わせて ることで、活性化の状態や局在を解析することもできます。 さらには、サイトカインやシグナル伝達分子などにより、細胞の様々なイベントや分子機構を解析することで、Th1, Th2, Th17, Treg, Th9各T細胞サブセットの異なる機能を解析することができます。
Major Known T Cell Markers
| Type of Cell | Cytotoxic | Th1 | Th2 | Th91 | Th17 | Tfh2 | Treg |
|---|---|---|---|---|---|---|---|
| Main Function | Kill virus-infected cells | Activate microbicidal function of infected macrophages and help B cells to produce antiboday | Help B cells and switch antibody isotope production | T cell proliferation and enhance IgG and IgE production by B cells | Enhance neutrophil response | Regulate development of antigen specific B cell development and antibody production | Immune regulation |
| Pathogens Targeted | Viruses and some | Inracelluar pathogens | Parasites | Parasites | Fungi and extracellular bacteria | ||
| Extracellular Markers | CD8 | CD4, CXCR3 | CD4, CCR4, Cith2 (human) | CD4 | CD4, CCR6 | CD4, CXCR5 | CD4, CD25 |
| Differentiation Cytokines | IFN-y, IL-2, IL-12, IL-18, IL-27 | IL-4, IL-2, IL-33 | IL-4, TGF-β | TGF-β, IL-6, IL-1, IL-21, IL-23 | IL-12, IL-6 | TGF-β, IL-12 | |
| Effector Cytokines | IFN-y, TNF, LT-α | IFN-y, LT-α, TNF | IL-4, IL-5, IL-6, IL-13 | IL-9, IL-10 | IL-17A, IL-17F, IL-21, IL-22, IL-26, TNF, CCL20 | IL-21 | TGF-β, IL-10 |
| Transcription Factors | T-bet, Stat1, Stat6 | GATA3, Stat5, Stat6 | GATA3, Smads, Stat6 | RORyet, RORα, Stat3 | Bci-6, MAF | FoxP3, Smad3, Stat5 |
Markers can be altered as a result of cellular environment, differentiation state, and other factors. Key cytokine appear in bold. BD Biosciences offers reagents for molecules that are green.
- Soroosh P. Doherty TA. Th9 and allergic disease. Immunology. 2009; 127:450-458.
- Fazilleau N, Mark L, McHeyzer-Williams LJ, McHeyzer-Williams MG. Follicular helper T cells: lineage and location. Immunity. 2009:30:324-355
細胞分取装置を用いたターゲット細胞の分取
ターゲットの細胞集団は、 BD FACSAria™ III, BD FACSMelody™ および BD FACSymphony™ S6 Flow フローサイトメトリーなどのセルソーターと表面マーカーの特定の組み合わせを使用して、ヘテロな細胞集団から分離することができます。 純化された生細胞集団は、培養で増殖、分化、維持することができます。 特定のアプリケーションでは、BD Biosciencesの科学者は、CD4に富む細胞を使用してヒトTreg細胞を分離し、CD4 + CD25 int-hiCD127低表現型でソートする方法など、ソートの詳細なプロトコルを考案しました。これにより、効率が向上し、収量が増加します。
T細胞による特異的な免疫応答とサイトカインの検出
細胞内フローサイトメトリーは、ヘテロな細胞集団の分泌物質を複数同時に測定することができます。サイトカイン環境によってその役割を変え自らもサイトカインを分泌してその機能の一部を発揮するT細胞サブセットの研究においては必須の技術です。例えば、マルチカラーフローサイトメトリーで、細胞内サイトカインと併せて解析することにより、Th1、Th2、またはTh17細胞を特定できます。このように細胞を物理的に分離せずとも、それぞれのサブセットにおける免疫応答の解析が可能になります。
細胞内サイトカインの検出
細胞内タンパク質を検出するには、細胞を固定して透過処理し、蛍光抗体が目的の標的タンパク質に侵入して検出できるようにする必要があります。抗原が異なれば、固定と透過処理に対する感度と要件も異なり、プロトコールの追加、最適化が必要になります。分泌タンパク質であるサイトカインを検出するには、細胞内にタンパク質を貯蔵するタンパク質輸送阻害剤が必要です。 BD Biosciencesは、細胞内サイトカイン検出に広く使用されている2つのアッセイシステムを提供しています。BDCytofix/ Cytoperm™試薬とBDFastImmune™サイトカインシステムです。どちらのシステムも、既にプロトコールが確立されており、簡便さと信頼性を研究者に提供し、BDフローサイトメトリー製品で知られている高水準の品質と再現性を組み込んでいます。 BDPhosflow™試薬は、マルチカラーフローサイトメトリーを使用して、T細胞シグナル伝達に関与するリン酸化タンパク質のレベルを確実に測定し、データをサブセットの同定と組み合わせるのに役立ちます。
BD Cytofix/Cytoperm™ 試薬
BD Cytofix / Cytoperm™試薬法および関連試薬は、基礎研究の幅広い実験ニーズに対応します。 BD Cytofix / Cytoperm™試薬は、サイトカインと複数の種を幅広く選択できる製品で、細胞内サイトカイン染色に最大限の柔軟性を提供します。 BD Biosciencesは、細胞内フローサイトメトリーを通じて細胞内サイトカイン を測定するためのいくつかのソリューションを提供しています。
BD FastImmune™ 試薬
BDFastImmune™システムは、ヒトサンプルの応用研究のニーズを満たすように設計されています。 完全なシステムに焦点を当てたこのアプローチは、疾患中の免疫状態またはワクチン候補に対する免疫応答を監視する研究研究に非常に適しています。 BDFastImmune™CD4細胞内サイトカイン検出キットAnti-Hu-TNF-α/ CD69 / CD4 / CD3は、全血中の抗原活性化CD4 + Tリンパ球における細胞内サイトカインおよび活性化マーカーCD69の検出用に設計されています。 アプリケーションには、ヘルペスウイルス、HIV、腫瘍抗原などの抗原に対するT細胞応答の研究が含まれます。 BD Biosciencesは、細胞内フローサイトメトリ を通じて細胞内サイトカインを測定するためのいくつかのソリューションを提供しています。
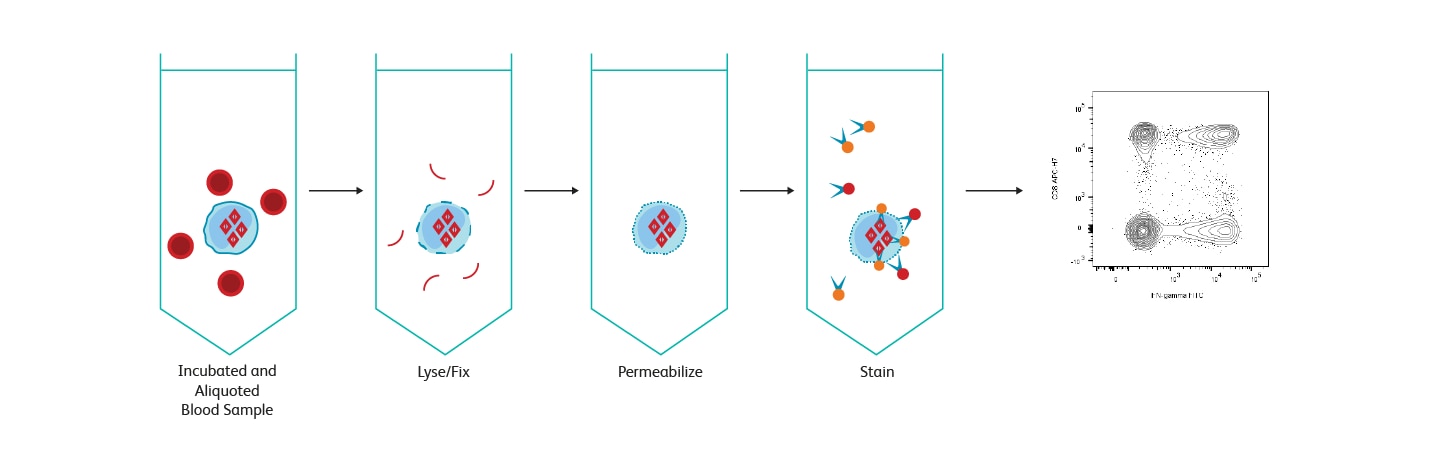
BD FastImmune™ サイトカインシステムのワークフロー
細胞内シグナリング
リン酸化による活性化のカスケード反応を捉えるBD Phosflow™テクノロジー
T細胞は、抗原やサイトカインの受容体、キナーゼ、転写因子など、いくつかのシグナル伝達分子が関与する複雑な経路によって活性化および調節されます。 タンパク質のリン酸化を伴うシグナルは、ナイーブCD4 + T細胞のTh1、Th2、Th9、Th17、Tfh、またはTreg細胞への分化に関与します。
リン酸化シグナルの検出: BD Phosflow™ 試薬
画期的なBD Phosflow™ 試薬は、培養細胞株やプライマリーの刺激により誘導される細胞内リン酸化タンパク質の検出をフローサイトメトリーを用いて可能にします。BDPhosflow™試薬アプローチは、シグナル伝達タンパク質のリン酸化が特定のT細胞表現型の発現につながるT細胞の研究に特に有用なツールです。
分泌サイトカイン(可溶性因子)
サンプル内の分泌サイトカインを検出するために、BDは複数のアッセイを提供しています。 BD® Cytometric Bead Array (CBA) テクノロジーにより、複数の可溶性サイトカインを同時に定量できます。 BD OptEIA™ ELISA 試薬 は、単一のサイトカインの定量用に設計されています。 BD® ELISPOT Reagents 試薬はサイトカイン産生細胞の頻度の測定を可能にし、BD® InVivo CaptureAssaysはinvivoでサイトカインを直接捕捉することにより定量を可能にします。
制御性T細胞のモニタリング
FoxP3 の測定
FoxP3 (あるいはScurfin, IPEX, JM2) は、抑制活性をもつ全てのCD4+Treg細胞で発現し、発生・分化・抑制機能を発揮するに必須とされています。11マウスの先天性自己免疫疾患Scurfy、およびヒトの遺伝性免疫疾患、IPEX(X連鎖免疫調節異常・多発性内分泌障害腸症候群)の原因遺伝子はFoxp3遺伝子であり、突然変異を生じるとその大半においてTregの発生が阻害され免疫系が破綻します。
FoxP3は、単離されたTregの純度確認や固定細胞のTreg解析に有用です。FoxP3の染色は細胞の固定と膜透過処理を要するので、生細胞のままTreg細胞を分離するにあたり使用することに適していません。このような場合には、CD127-の使用が良い例として挙げられます。ヒトFoxP3モノクローナル抗体クローン259D/C7は、ヒトFoxP3転写因子の現在同定されている全てのアイソフォームと反応し、カニクイザル、アカゲザル、およびオナガザルと交差反応します。
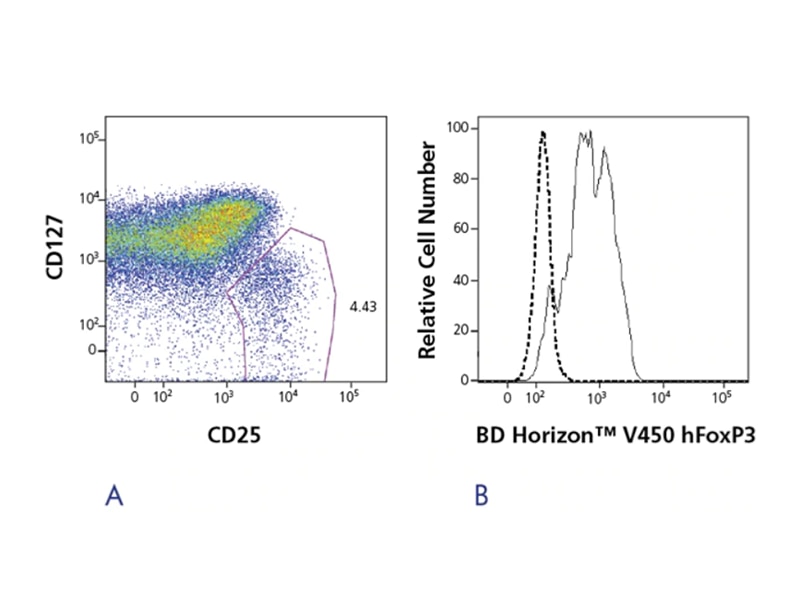
BD Pharmingen™ HumanFoxP3抗体は、複数のサイズと蛍光標識で入手可能で、FoxP3陽性Tregを検出するための試薬です。 使いやすいバッファーシステムにより、研究者はわずか数ステップで細胞を固定および透過処理でき、最大72時間までサンプルを凍結することができます。 FoxP3はTregの同定、分離、および特性評価に一般的に使用されるマーカーですが、Tregは非常に活発な研究分野であり、ターゲットの新しいリストが文献に公開されています。 これらの新たな発見をサポートするために、新しい高品質の試薬とソリューションのBD Biosciencesポートフォリオは成長を続けています。
CD39: Enhanced characterization of Tregs
CD39は、主としてB細胞、樹状細胞、いくつかのT細胞サブセットに局在するとされましたが、近年ヒトおよびマウスのCD4 +TregsにFoxP3と共発現していることが示されました。 15 Tregの同定と機能特性の分析に、CD25、CD45RA、HLA-DRおよびCTLA-4等に加えて重要な細胞表面抗原です。
CD39は、細胞外ATPを、ヌクレオチドに加水分解します。細胞外ATPと代謝物は細胞と臓器機能を調節し、ATP放出により組織破壊、免疫活性化が起こます。細胞外ATPはCD39に加水分解された後、さらにCD73によってヌクレオシド(例:アデノシン)に速やかに分解されます。アデノシンは、抗炎症性T細胞反応を媒介するため、CD39とCD73の共発現は、Tregによる免疫抑制の主要メカニズムの一つと考えられています16
BD Pharmingen™ Anti-HumanCD39(クローンTÜ66)モノクローナル抗体は、ヒトTregのマーカーであり、フローサイトメトリー用のすぐに使用できる試薬キットでも利用できます。 TÜ66は、エクトヌクレオシド三リン酸ジホスホ加水分解酵素(E-NTPDase)のファミリーに属する外部酵素であるENTPD1を認識します。 このファミリーのメンバーは、細胞外ヌクレオチド異化作用に関与し、細胞外ヌクレオシド三リン酸プール(NTP)を制御します。
CD152: CTLA4
Cytotoxic T lymphocyte antigen 4 (CTLA-4 or CD152)は、Treg抑制機能に重要です。 CD152の遮断は、Tregの抑制活性を損ないます。 CD152発現の異常は、関節リウマチなどの自己免疫疾患に関与していることが報告されています。15 定義された集団、既存のマーカー、および新たなマーカーの存在は、Treg生物学における刺激的な新しい発見に大きく貢献します。
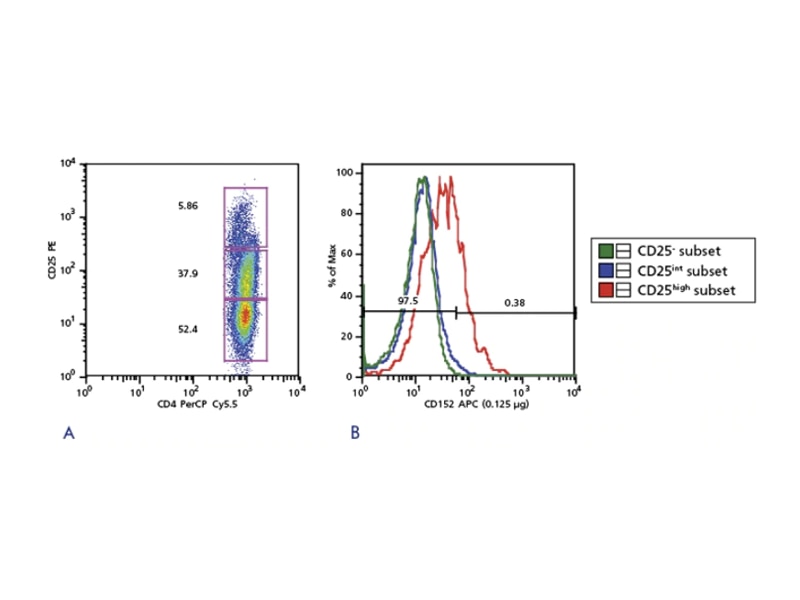
Treg の濃縮
Tregは少数の細胞集団であり、下流の解析には濃縮が必要な時があります。Treg全体またはその亜集団を濃縮するための方法は、いくつかあります。FoxP3は最も重要なTregマーカーであると考えられていますが、細胞内に存在しているいため生細胞Tregの分離に使用することはできません。濃縮は、様々なマーカーを組み合わせて行います。ネガティブセレクションの例に、CD127とCD49dを発現する細胞を除く方法があります。10 CD4+CD25high 細胞集団はポジティブセレクションに使われます。まず、細胞ソーティング前に、磁気ビーズ使用して大まかに不要な細胞集団を除き、次にCD4+, CD25+, CD127-細胞を濃縮します。
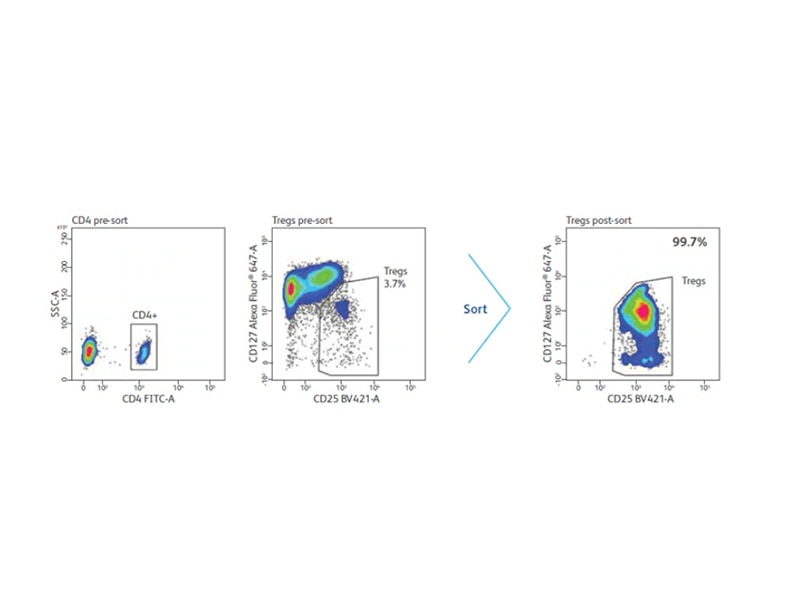
CD4とCD25を利用したTregの濃縮
近年、CD25+細胞集団のほとんどがTregと考えられるマウス細胞とは対照的に、ヒトTregは、ex vivoでCD4+ T細胞の約2‐3%に当たる、CD25high細胞集団のみが、in vitroで抑制活性を示すということが明らかになりました。さらに、CD25low/intermediateである細胞集団は、ex vivoにおいて直接抑制活性を示さないと考えられています
加えて、CD25発現レベルの定義は、はっきりとしていないため、多くの研究者は最も高いCD25発現レベルの細胞集団のみを選択し、結果として分離されるTreg収量は低いままでした。これらの背景を踏まえ、ヒトTregにしかない細胞表面抗原を特定する研究が進んできています。18
ヒトTreg収量が向上するCD4+ T細胞の磁気ビーズによる前濃縮
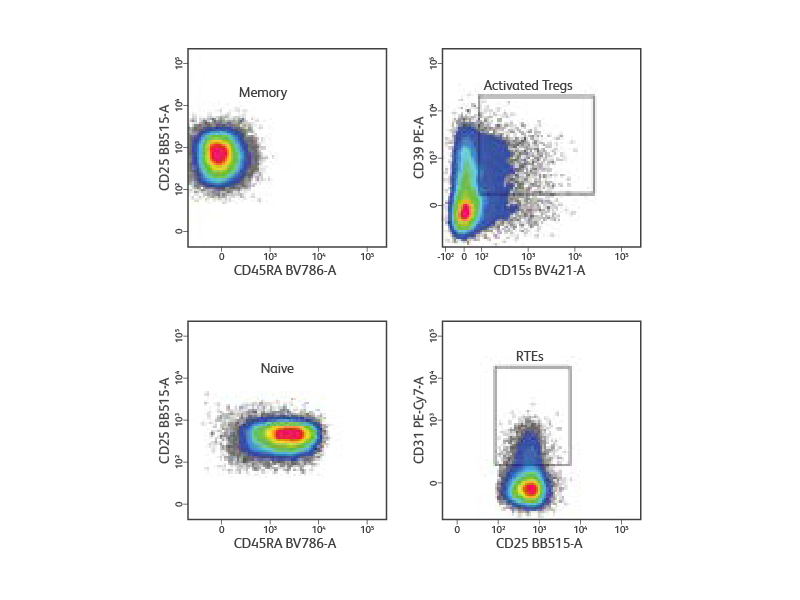
Peripheral blood mononuclear cells were isolated from a healthy donor and stained with a cocktail of surface markets (CD3, CD4, CD25, CD127, and CD45RA) for the detection and purification of Treg subsets. Lymphocytes and singlets were first gated based on light scatter properties followed by gating of CD3+CD4+ T cells (not shown). Tregs were identified as CD127low/neg CD25high. From the Treg gate, CD45RA+ naive and CD45RA- memory Tregs were identified and sorted at 5,000 events/sec in purity mode. Post-sort analysis revealed homogenous populations of memory and naive Tregs. Purified cells were then stained for additional surface markers (CD31, CD39 and CD15s) for immunophenotyping. CD31+ recent thymic emigrants (RTEs) were detected within CD45RA+ naive Tregs, whereas highly activated Tregs were detected within CD45RA- memory Tregs.
References
- Di Caro V, D'Anneo A, Phillips B, et al. Interleukin-7 matures suppressive CD127(+) forkhead box P3 (FoxP3)(+) T cells into CD127(-) CD25(high) FoxP3(+) regulatory T cells. Clin Exp Immunol. 2011;165(1):60-76. doi:10.1111/j.1365-2249.2011.04334.x
- Tøndell A, Wahl SGF, Sponaas AM, Sørhaug S, Børset M, Haug M. Ectonucleotidase CD39 and checkpoint signalling receptor programmed death 1 are highly elevated in intratumoral immune cells in non-small-cell lung cancer. Transl Oncol. 2020;13(1):17-24. doi:10.1016/j.tranon.2019.09.003
- de Oliveira Bravo M, Carvalho JL, Saldanha-Araujo F. Adenosine production: a common path for mesenchymal stem-cell and regulatory T-cell-mediated immunosuppression. Purinergic Signal. 2016;12(4):595-609. doi:10.1007/s11302-016-9529-0
- Attias M, Al-Aubodah T, Piccirillo CA. Mechanisms of human FoxP3+ Treg cell development and function in health and disease. Clin Exp Immunol. 2019;197(1):36-51. doi:10.1111/cei.13290
-
Application Notes
-
Delineation of Functional T reg Subsets Using Cell Surface Marker Expression - Panel Sheet
-
Detection of Intracellular Cytokines in T Lymphocytes using the BD FastImmune™ Assay on the BD FACSVerse™ System
-
Studying Mouse Thymocyte Development using Multiparametric Flow Cytometry: An Efficient Method to Improve an 8-Color Panel on the BD FACSVerse™ System
-
Brochures
-
Frequently Asked Questions
-
Product Information Sheets
-
BD® CBA Human and Mouse Th1/Th2/Th17 Kit
-
BD Pharmingen™ CD4+ T Cell Phenotyping Kits
-
BD Pharmingen™ Transcription Factor Buffer Set
-
BD Human Regulatory T Cell Cocktail (CD4/CD25/CD127)
-
Human CD39 Reagents
-
Human FoxP3
-
Human Th17 Research Products
-
Human and Mouse Reactive T-bet Monoclonal Antibodies
-
Mouse Foxp3
-
Mouse Th17 Reagents
-
Unique Markers for the Study of Human Activated Regulatory T Cells: GARP, LAP, and SATB1
-
Protocols
- Activation of Immune Cells for Cytokine Production
- BD Cytofix/Cytoperm Method for Immunofluorescent Staining of Intracellular Cytokines for Flow Cytometric Analysis
-
BD Pharmingen™ Transcription Factor Buffer Set, Cat. Nos. 562725, 562574
-
CD3 Plate Stimulation Protocol of Murine T Cells for the Detection of Activation Markers
-
Protocol for CD3 Stimulation of Human T Cells for the Detection of Activation Markers
-
Simultaneous Measurement of Cell Surface Markers with FoxP3 and Stat5 (pY694) in IL-2– Stimulated Human PBMCs using BD Cytofix™ Fixation Buffer and BD Phosflow™ Perm Buffer III
-
Webinars
For Research Use Only. Not for use in diagnostic or therapeutic procedures.
Cy is a trademark of Global Life Sciences Solutions Germany GmbH or an affiliate doing business as Cytiva.