-
抗体試薬
- フローサイトメトリー用試薬
-
ウェスタンブロッティング抗体試薬
- イムノアッセイ試薬
-
シングルセル試薬
- BD® OMICS-Guard Sample Preservation Buffer
- BD® OMICS-One Protein Panels
- BD® AbSeq Assay
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ ATAC-Seq Assays
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Accessory Kits
- BD® OMICS-One Immune Profiler Protein Panel
- BD OMICS-One™ WTA Next Assay
-
細胞機能評価のための試薬
-
顕微鏡・イメージング用試薬
-
細胞調製・分離試薬
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location site or be switched to your location?

移植
幹細胞移植は、癌患者に対する高用量化学療法(HDC)の後、患者の血液細胞および免疫細胞の産生能を回復させるために実施されます。毎年、30,000人を超える血液関連の悪性腫瘍患者がHDCを受けており、治療が奏功した場合は造血幹細胞移植(HSCT)が引き続き実施される可能性があります1。 移植細胞源の拡大など移植技術の改善により、幹細胞移植における罹患率や死亡率は従来法に比べ顕著に低下しています。HDC後の幹細胞移植は、多発性骨髄腫、初回寛解後の骨髄性白血病、および中悪性度非ホジキンリンパ腫に対する治療法として、現在では標準療法になっています。
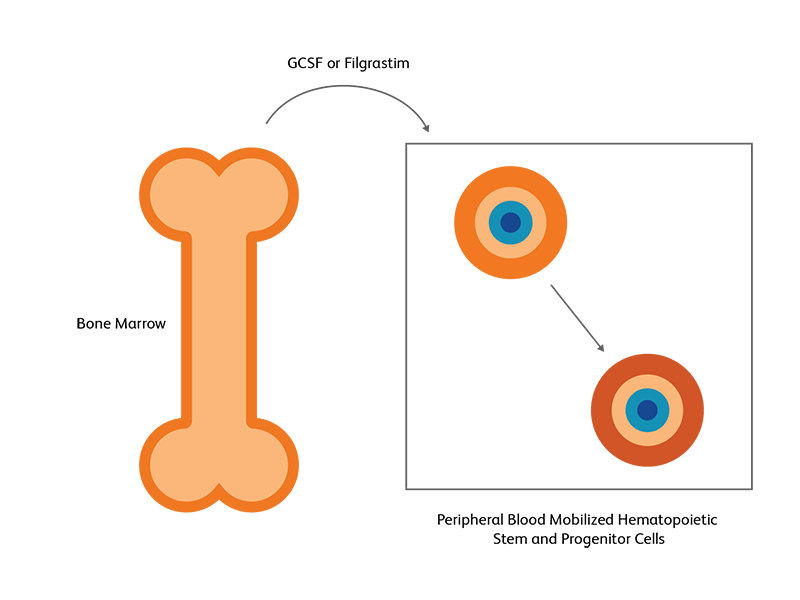
移植幹細胞源としての骨髄と末梢血
成長因子療法や化学療法に対する反応として、骨髄造血幹細胞(HSC)の末梢血への移動が誘発されることがあります。この特性は、自家および同種異系の造血幹細胞移植術において利用されています2。 HSCは、主に骨髄ニッチ内に存在することが確認されており、一部は末梢血中にも認められます3。 末梢血中のHSC量は、化学療法や成長因子療法(顆粒球コロニー刺激因子 [G-CSF] 、フィルグラスチムなど)といった外因性刺激によって、骨髄中の量と同等またはそれ以上のレベルにまで増加します。このような、薬理学的に誘発されたHCSの末梢血への移動は、末梢血動員と呼ばれており、移植術のために末梢血のHSC量を増やす戦略とし優先的に利用されています3。 自家造血幹細胞移植では、ほぼ全ての症例において末梢血が使用されています。一方、同種異系造血幹細胞移植の場合は、末梢血中のT-リンパ球(T細胞)によって障害が発生する可能性があります2。 このため、血液中のCD45+/CD34+生細胞数を測定し、移植用としての適切性が判断されます。
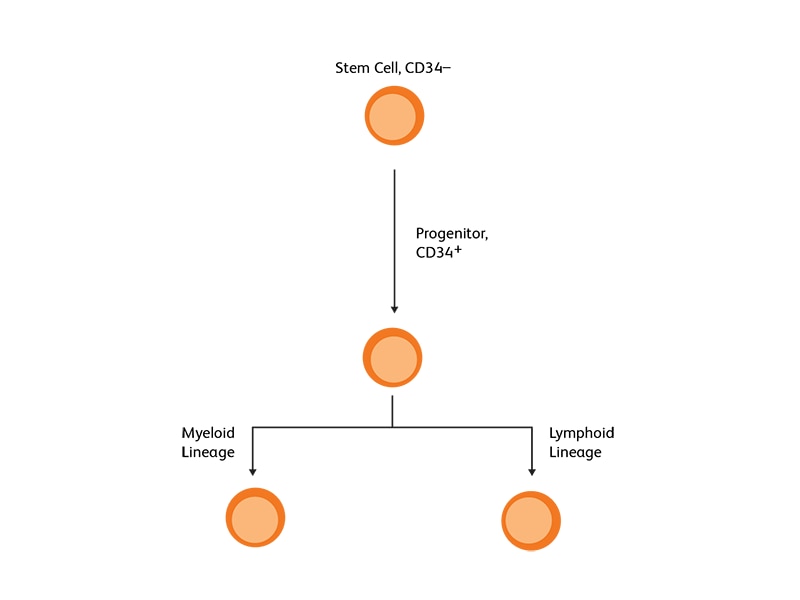
造血幹細胞マーカーとしてのCD34
CD34は膜貫通型リン糖タンパク質であり、骨髄や血液中の未熟造血前駆細胞と、単能性および多能性の前駆細胞を含む全ての造血コロニー形成細胞の表面に発現しています4。 細胞表面CD34タンパク質は、歴史的に造血細胞との関連性が指摘されており、HSCのマーカーと考えられています。大半の造血器悪性腫瘍に対しては、化学療法後にCD34陽性の造血幹細胞/前駆細胞を回収して患者に移植する治療法が極めて重要です。G-CSFは、CD34陽性細胞の血中濃度を上昇させることが知られており、自家HSCTでは実質的に全症例で、また同種異系HSCTの場合も大半の症例において、造血幹細胞動員剤として一般的に使用されています。
CD34陽性細胞数の測定と選別
CD34陽性細胞数を正確に測定することは、用量の値が必要となる幹細胞移植プロトコールにおいては極めて重要です5。 測定値が実際より高い場合、移植注入液量が、必要とされる閾値用量に達していないことになります。また、細胞数の正確な測定は、造血幹細胞の動員効果やアフェレーシスセッション実施の最適なタイミングの見極めに必要な、充分量のCD34陽性細胞が回収されたことの確認に役立ちます。フローサイトメトリーによるCD34陽性の造血幹細胞/前駆細胞の測定法は、骨髄や幹細胞の移植効果を評価する方法として確立されています6。 Milan/Mulhouseや国際血液療法・移植学会(ISHAGE)などによるプロトコールを用いた初期のフローサイトメトリー法7では、フローサイトメーターと自動血液分析装置の2種類を使用しています。近年の単一装置による方法では、フローサイトメーターをCD34陽性細胞の絶対数測定専用装置として用い6、 CD34タンパク質分子を特異的に認識する蛍光色素標識モノクローナル抗体を併用することで、フローサイトメーターにより細胞を識別し、且つ計数することができます。これにより、前駆細胞集団における様々なCD34陽性細胞の迅速な検討が可能になります。また、フローサイトメーターは再現性にも優れています。抗CD34モノクローナル抗体により検出されるCD34分子やエピトープの構造的特徴を考慮に入れ、標準化ISHAGEプロトコールを開発することで7、 フローサイトメトリーによるCD34陽性細胞の検討がさらに有用なものになります。
CD34陽性細胞を識別するためのBDバイオサイエンスのフローサイトメーターとアッセイキット
BD® Stem Cell Enumeration (SCE) Assayでは、CD34陽性およびCD45陽性の生細胞数を全白血球に対する割合として測定します。また、正確度と再現性に優れた単一プラットフォームに適合する、BD Trucount™の技術が用いられています7。 このアッセイ法による細胞亜集団の識別は、自動でゲーティングおよび解析が行われますが、マニュアルによるゲーティングも可能です。
CD34やCD45の陽性細胞数は、BD Trucount™チューブに予めセットされている試薬により細胞を染色することで、細胞の絶対数を測定することができます。チューブに細胞を添加すると、チューブ内の蛍光色素標識モノクローナル抗体が細胞表面に特異的に結合します。さらに、チューブ内の凍結乾燥ペレットが溶解し、遊離した既知数の蛍光色素ビーズも細胞に結合します。生細胞数の測定は、死細胞だけが染色される7-AAD色素を用いて行います。その後、試料に塩化アンモニウムを添加して赤血球を溶解処理し、フローサイトメーターで測定します。結果は、CD34陽性細胞とCD45陽性生細胞それぞれの濃度、およびCD45陽性生細胞集団中に存在するCD34陽性生細胞数の割合として得ることができます。
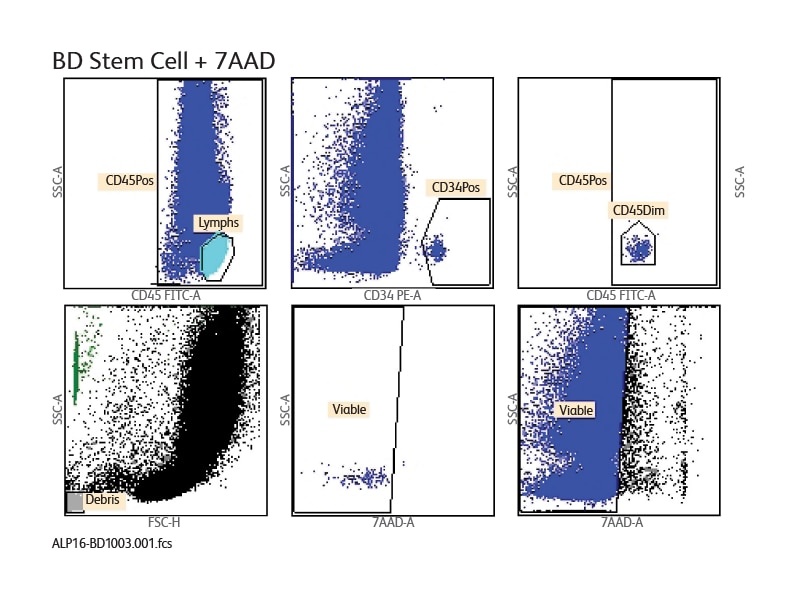
BD® Stem Cell Enumeration Assayキットによる参考データ
BD® Stem Cell Enumeration (SCE) Kitを使用して調製した試料をBD FACSCanto™フローサイトメーターで解析することにより、CD34陽性生細胞の絶対数および存在比率が測定されます。以下のデータは、このキットとBD FACSCanto™ II フローサイトメーターを用いて実施した試験の報告例です。試料ごとにデータを解析して図にプロットし、QC内容も表示されています。
販売名: BD FACSCanto フローサイトメーター 届出番号07B1X00003000146
販売名: BD FACSCanto II フローサイトメーター 届出番号:07B1X00003000102
The BD® Cell Stem Enumeration Kit available for use with the BD FACSCanto™ System combines the precision of the BD Trucount™ Absolute Counting Beads with ISHAGE-based protocol guidelines for standardized and accurate results.
References
- Doulatov S, Notta F, Laurenti E, Dick JE. Hematopoiesis: A human perspective. Cell Stem Cell. 2012;10(2):120-136. doi: 10.1016/j.stem.2012.01.006
- Jansen J, Hanks S, Thompson JM, Dugan MJ, Akard LP. Transplantation of hematopoietic stem cells from the peripheral blood. J Cell Mol Med. 2005;9(1):37-50. doi: 10.1111/j.1582-4934.2005.tb00335.x
- Karpova D, Rettig MP, DiPersio JF. Mobilized peripheral blood: an updated perspective. F1000Res. 2019;8:F1000 Faculty Rev-2125. doi: 10.12688/f1000research.21129.1x
- Schlossman SF, ed. Leucocyte Typing V: White Cell Differentiation Antigens. Oxford University Press; 1995. 1:840-846.
- Langermayer I, Weaver C, Buckner CD, et al. Engraftment of patients with lymphoid malignancies transplanted with autologous bone marrow, peripheral blood stem cells or both. Bone Marrow Transplant. 1995;15(2):241-246.
- Gajakowska A, Oldak T, Jastrzewska M, et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 2006;44(1):53-60.
- Sutherland DR, Anderson L, Keeney M, Nayar R, Chin-Yee I. The ISHAGE guidelines for CD34+ cell determination by flow cytometry. J Hematother. 1996;5(3):213-226. doi: 10.1089/scd.1.1996.5.213
The BD® Stem Cell Enumeration (SCE) Kit provides simultaneous enumeration of viable dual-positive CD45+/CD34+ hematopoietic stem cell populations in CD34+ absolute counts (cells/μL) as well as the percentage of the total viable leukocyte count that is CD34+ (%CD34). The following specimens can be analyzed with this kit: normal and mobilized peripheral blood, fresh and thawed leukopheresis products, fresh and thawed bone marrow, and fresh and thawed cord blood. The kit is intended for in vitro diagnostic (IVD) use on either a BD FACSCalibur™ Flow Cytometer using BD CellQuest™ or BD CellQuest™ Pro Software or a BD FACSCanto™ II Flow Cytometer using BD FACSCanto™ Clinical Software.
BD flow cytometers are Class 1 Laser Products.