-
抗体試薬
- フローサイトメトリー用試薬
-
ウェスタンブロッティング抗体試薬
- イムノアッセイ試薬
-
シングルセル試薬
- BD® OMICS-Guard Sample Preservation Buffer
- BD® OMICS-One Protein Panels
- BD® AbSeq Assay
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ ATAC-Seq Assays
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Accessory Kits
- BD® OMICS-One Immune Profiler Protein Panel
- BD OMICS-One™ WTA Next Assay
-
細胞機能評価のための試薬
-
顕微鏡・イメージング用試薬
-
細胞調製・分離試薬
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location site or be switched to your location?

フローサイトメトリー検査 Q&A
Q. 細胞表面抗原の染色方法について教えてください。
A.<使用試薬>
- 蛍光標識モノクローナル抗体
- BD FACS™Lysing Solution (Cat.349202)
- BD CellWASH™ (Cat. No.349524)アジ化ナトリウム加PBS(-)
<サンプル調製>
- チューブに試薬名等をラベルします。
- 室温に戻した抗体を試験管の底に加えます。
- 検体100μL(0.5-1.0x106cells)を分注します。
- ボルテックスし、20-25℃、暗所にて15分間インキュベートします。
- イオン交換水にて10倍希釈したFACS™Lysing Solutionを2mL加えます。
- 室温、暗所にて10分間インキュベートします。
- 300-540×g、 5分間遠心し、上清を除去します。
- ボルテックスでペレットを壊し、PBS 2.0mLを添加、 7. を繰り返します。
- ボルテックスでペレットを壊し、PBS 0.5mLを添加し、細胞浮遊液にします。
※ただちに測定しない場合は、1%パラホルムアルデヒドPBS溶液に再浮遊し、冷暗所にて保存してください。
表面免疫グロブリンを染色する場合は、検体の血漿中に含まれる免疫グロブリンを除去するため、前洗浄が必要となります。
<使用試薬>
- 蛍光標識モノクローナル抗体
- BD FACS™Lysing Solution (Cat.349202)
- BD CellWASH™ (Cat. No.349524)アジ化ナトリウム加PBS(-)
<サンプル調製>
- チューブに試薬名等をラベルします。
- 検体100μL(0.5-1.0x106cells)を分注します。
- PBS 3.0mLを添加します。 *最低検体の30倍量のPBSを添加してください。
- 300-540×g、 5分間遠心し、上清を除去します。
- 3.、4. を繰り返します。 *PBSで2回洗浄を行います。
- ボルテックスして、ペレットを壊し、抗体を加えます。
- 室温、暗所にて15分間インキュベートします。
- イオン交換水にて10倍希釈したFACS™Lysing Solutionを2.0mL加えます。
- 室温、暗所にて10分間インキュベートします。
- 300-540×g、 5分間遠心し、上清を除去します。
- ボルテックスでペレットを壊し、PBS(-) 2.0mLを添加、10. を繰り返します。
- ボルテックスでペレットを壊し、PBS(-) 0.5mLを添加し、細胞浮遊液にします。
※ただちに測定しない場合は、1%パラホルムアルデヒドPBS溶液に再浮遊し、冷暗所にて保存してください。
Q. 細胞内抗原の染色方法について教えてください。
A. 弊社BD IntraSure™ Kitを使用した細胞内抗原染色の手順をご紹介いたします。細胞表面抗原の染色も同時に行う場合は、必ず細胞表面抗原の染色から行ってください。
なお、他社からも同様の製品が販売されておりますが、手順につきましてはそれぞれの取扱説明書をご確認ください。
<使用試薬>
- 蛍光標識モノクローナル抗体
- BD IntraSure™ Kit(Cat. No. 641778)
- BD FACS™Lysing Solution (Cat.349202)
- BD CellWASH™ (Cat. No.349524)アジ化ナトリウム加PBS(-)
- BD CellFIX™(Cat. No.340181)
<サンプル調製>
I.細胞表面抗原の染色・固定
- チューブに試薬名等をラベルします。
- 検体50μLを分注します。
- 表面抗原を染色する抗体を添加し、室温、暗所にて15分間インキュベーションします。
- 試薬Aを100µL加え、Vortexします。
- 室温、遮光で5分間インキュベーションします。
II. 溶血
- 1×BD FACS™Lysing Solutionを2mL加えます。
- Vortexし、室温、暗所で10分間インキュベーションします。
- 800-850×gで5分間遠心します。
- ペレットを除去しないように、上清を除去します。
III.細胞内抗原の染色
- 50µLの試薬Bを加えます。
- 細胞内抗原を染色する抗体を添加し、Vortexします。
- 室温、遮光で15分間インキュベートします。
- 2.0-3.0mLのBD CellWASH™、もしくは0.1%アジ化ナトリウム加PBSを加え、Vortexします。
- 800-850×gで5分間遠心します。
- 上清を除去します。
- 0.5mLのBD CellFIX™、もしくは1%パラホルムアルデヒドPBSを加え、Vortexします。
- 2-8℃、遮光下で30分間細胞を固定します。
- 測定前にもVortexで撹拌を行ってください。
Q. 検体はどのように保存すればよいでしょうか?また、調製した検体についてはどのように保存すればよいですか?
A. 末梢血や骨髄穿刺液などの検体は、採取後すぐに処理するのが理想的ですが、それが困難な場合は18-22℃で保管し、24時間以内に測定することが望ましいとされています。末梢血や骨髄穿刺液からリンパ球や腫瘍細胞を分離した試料や、その他の体液については10% FCS加培養液に細胞を再浮遊した後4℃で保存し、24時間以内に測定することが推奨されております。
リンパ節や節外組織から調製した細胞浮遊液は、培養液中で室温、あるいは2-4℃で短時間維持することが可能です。
染色後の検体を保存したい場合、もしくは感染性の検体で不活化した後の測定が望まれる場合にはpH7.0-7.4緩衝パラホルムアルデヒド、もしくはホルムアルデヒド(0.1-2.0%)溶液に試料を再浮遊させ、遮光し4℃で保管します。溶血剤、固定剤の種類や濃度により保存可能な時間は異なるため、保存可能時間につきましては各施設での検討が必要となります。弊社BD CellFIX™(Cat. No. 340181)を使用しますと、遮光し2-8℃で24時間保存が可能です。タンデム色素を使用する場合には、Stabilizing Fixative 3X Concentrate (Cat.No.338036) を使用してください。
参考文献
- フローサイトメトリーによる造血器腫瘍細胞表面抗原検査に関するガイドライン(JCCLS H2-P V1.0)
- フローサイトメトリーによる末梢血リンパ球表面抗原検査に関するガイドライン(H1-A V2.0)
- フローサイトメトリーによるCD34陽性細胞検出におけるガイドライン(JCCLS H3-P V1.0)
- Clinical Applications of Flow Cytometry: Quality Assurance and Immunophenotypin of Lymphocytes; Approved Guideline (NCCLS H42-A)
Q. 測定時にアイソタイプコントロールは必須でしょうか?
A. フローサイトメトリー法による細胞表面マーカー測定では、一般的にマーカー抗原に対する蛍光標識モノクローナル抗体の非特異結合や陽性/陰性のカットラインを確認するために、使用するモノクローナル抗体のアイソタイプ (マウスIgG1、マウスIgG2aなど) に合わせたアイソタイプコントロール抗体を反応させたサンプルを別途調製し、測定することが推奨されています。
臨床検査で行われる造血器腫瘍細胞表面抗原検査、リンパ球サブセット検査、CD34陽性細胞の絶対数測定におきましては、下記にまとめておりますのでご参照ください。
- 造血器腫瘍表面抗原検査
多種類の抗体を測定する造血器腫瘍細胞表面抗原検査においては、下記の理由により、アイソタイプコントロールによる陰性・陽性カットオフマーカーで抗原発現の有無が判定されるものではなく、測定する必要性がないと認識されています。
- 一つの色素に対して複数のアイソタイプを使用している場合は、同一色素でも複数種のアイソタイプコントロールが必要となるため、非特異反応があえて起こりやすいIgG2aを用いているのが現状である。
- 検体によっては、アイソタイプコントロールにのみ非特異反応が起こることがあり、判定に苦慮することがある。
- 対象抗原の未発現細胞に対する抗体反応性を陰性コントロールとして使用することができる。
- アイソタイプコントロールを反応させないunlabeled control を立て、細胞の自家蛍光による最少の蛍光バックグラウンドを確認し、陰性コントロールとすることができる。
- リンパ球サブセット検査
NCCLS, CDCのガイドラインにより下記に定義されたリンパ球サブセットマーカーにおいては、陰性集団と陽性集団が明確に分離しているため、陰性コントロールを立てる必要がないとされています。
| T細胞:CD3+ | ヘルパーT細胞:CD3+CD4+ |
| B細胞:CD19+ | 細胞傷害性T細胞:CD3+CD8+ |
| NK細胞:CD3-CD56+CD16+ |
- CD34陽性細胞絶対数測定
世界的に広く利用されていますISHAGEガイドラインでは、CD34の非特異的反応の影響を抑えるためにCD45抗体の併用、階層化ゲートの使用、7-AADによる死細胞の除外、統計学的なバラつきを抑えるために75,000個以上の細胞の測定、内部標準ビーズを使用したSingle platform法の使用が推奨されており、アイソタイプコントロールは不要とされております。
弊社BD™ Stem Cell Enumeration Kit(Cat. No.344563)ではISHAGEガイドラインに準拠していますので、アイソタイプコントロールは不要です。
参考文献
- フローサイトメトリーによる末梢血リンパ球表面抗原検査に関するガイドライン(H1-A V2.0)
- Clinical Applications of Flow Cytometry: Quality Assurance and Immunophenotyping of Lymphocytes; Approved Guideline (NCCLS H42-A)
- 1997 Revised Guidelines for Performing CD4+ T-Cell Determinations in Persons Infected with Human Immunodeficiency Virus (HIV) (CDC MMWR Recommendation Report January 10, 1997 / Vol. 46 / No. RR-2)
- フローサイトメトリーによるCD34陽性細胞検出におけるガイドライン(JCCLS H3-P V1.0)
- The ISHAGE guidelines for CD34+ cell determination by flow cytometry. D. Robert Sutherland et. al., Journal of Hematotherapy 5:213-226 (1996).
- Isotype Controls in the Analysis of Lymphocytes and CD341 Stem and Progenitor Cells by Flow Cytometry—Time to Let Go! M. Keeney et. al., Cytometry (Communications in Clinical Cytometry) 34:280–283 (1998).
Q. BD FACS™Lysing SolutionとBD PharmLyse™ Lysing bufferの違いは何ですか?
A. BD FACS™Lysing Solution(Cat. No. 349202)はジエチレングリコールベースの溶血剤と10%ホルムアルデヒドを含んだヒト専用の溶血固定剤となります。イオン交換水で10倍希釈してご使用ください。希釈液はガラス密閉容器であれば、室温で1か月保存可能です。固定剤により抗原抗体結合を保持でき、また検体中のウィルスをある程度不活化させることができますが、抗体染色前の赤血球溶血に使用すると、固定により充分な抗体染色ができないため、抗体染色後の溶血固定に使用してください。
BD PharmLyse™ Lysing buffer(Cat. No.555899)は塩化アンモニウムベースの溶血剤です。固定剤が含まれていないため、抗体染色前の赤血球溶血においても使用することができます。また核染色剤による細胞の生死判定を必要とする場合(CD34陽性細胞カウントなど)にはBD PharmLyse™ Lysing bufferをご使用ください。イオン交換水で10倍希釈してご使用ください。希釈液は4℃で30日間保存可能です。
Q. 溶血は抗体反応の前後どちらが良いでしょうか?
A. 溶血は抗体反応後の実施が一般的です。溶血剤には固定剤を含んでいるもの(例:BD FACS™Lysing Solution)があり、固定剤により、抗原抗体結合による表面抗原の変性を防ぐことができます。ただし、試料の細胞濃度を濃くするため、抗体反応前の溶血が必要な多発性骨髄腫等、造血器腫瘍の微少残存病変(MRD)解析などでは、固定剤を含まない塩化アンモニウムベース溶血剤を(例:BD PharmLyse™ Lysing buffer)を使用します。
Q. 赤血球の除去は全血溶血法と濃度勾配比重遠心細胞分離法のどちらが推奨されていますか?
A. 全血溶血法は短時間で処理することができ、濃度勾配遠心法に比べ、特定の分画を喪失せず白血球や腫瘍細胞の分布を維持できることから一般に推奨されています。なお、骨髄穿刺液の場合、全血溶血法では多染性赤芽球や正染性赤芽球は溶血されますので、注意が必要です。
濃度勾配比重遠心細胞分離法では白血病細胞を濃縮することができますが、目的としないリンパ球や単球などの濃縮や、白血病細胞が採取されない場合もございます。また、この方法は処理時間が長く、検体によっては赤血球が完全に除去されず、溶血操作を行わなければならないこともあります。しかし、骨髄穿刺液では全血溶血法と異なり、前赤芽球から正染赤芽球まで回収することが可能となります。
参考文献
- フローサイトメトリーによる造血器腫瘍細胞表面抗原検査に関するガイドライン(JCCLS H2-P V1.0)
- フローサイトメトリーによる末梢血リンパ球表面抗原検査に関するガイドライン(H1-A V2.0)
Q. 蛍光補正(Compensation)とは何ですか?
A.フローサイトメーターの検出器は、蛍光波長の全てを検出しているのではなく、色素ごとに決められた領域の波長の光を検出しています。例えばFITCでは515-545nm、PEでは565-605nmの蛍光波長を検出できるようになっており、FITCとPEの検出する領域が近くなります。一方、FITCは蛍光波長のピークである530nm付近だけでなく600nm付近まで、幅広い波長を示します。横軸に波長を示している下の図では、FITCは緑色で塗りつぶされた範囲の蛍光波長になります。この範囲はPEの検出領域にも重なってしまうため(図の水色の領域)、PEの検出器でも検出されてしまいます。この現象を蛍光の漏れ込み、あるいはSpill overと呼びます。
FITCのみで染色された細胞と何も染色されなかった細胞が混在したサンプルをFITC/PEのドットプロットで表示すると、FITC陽性の細胞集団がPE陽性であるかのような結果になり、測定結果に齟齬が生じてしまいます(下のドットプロット図)。このようにPEの検出器への漏れこみが生じると、本来PE陰性であるはずの集団が陽性集団かのように見えてしまいます。
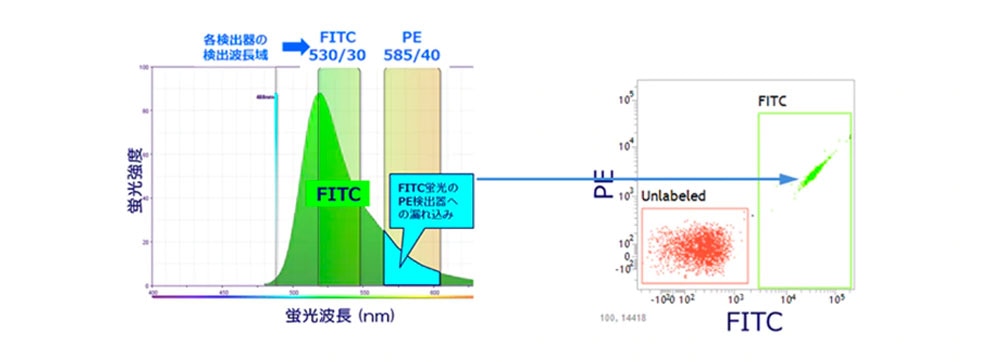
正しい結果を得るためには、この蛍光の漏れこみを、解析ソフトウェア上で補正することが必要です。この補正操作のことを蛍光補正、あるいは、コンペンセーションといいます。適切な蛍光補正が行われていない場合、下図のように細胞集団のパターンが大きく変化し結果の判定に影響してしまう可能性があります
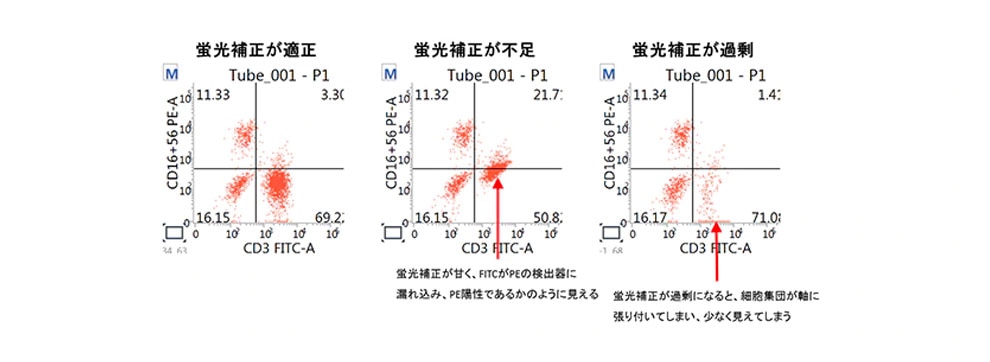
<蛍光補正の一例>
使用する蛍光色素のドットプロットにおいて、目的の蛍光色素による単染色サンプルを用いて、漏れ込みを確認します。他の検出器への漏れ込みが認められた場合、陽性集団の平均値(Mean)が陰性集団と同じ値になるように蛍光補正を行います。使用する抗体量や抗原量、細胞の状態、タンデム色素のロット差などにより蛍光補正値は変動する可能性があります。
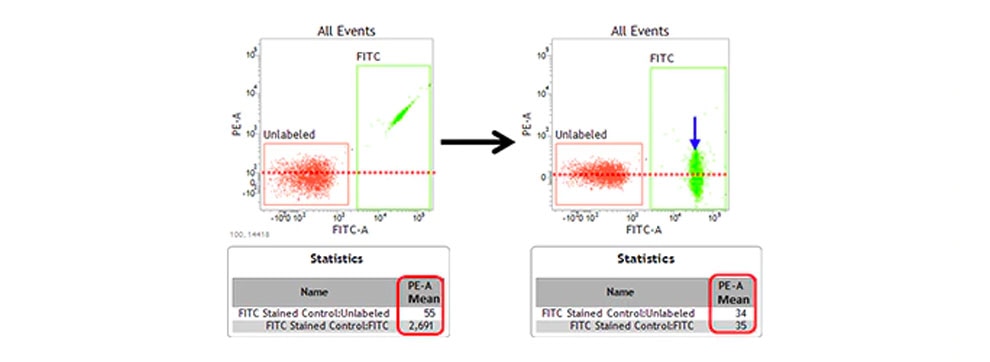
なお、単染色での測定、あるいは漏れ込みがない色素の組み合わせである場合は、考慮する必要はありません。
Q. リバースピペッティング(リバース法)とは何ですか?
A. あらかじめ規定量よりも多く試料を吸引しておき、排出時に規定量を分注する方法です。 粘着性のある全血などでは、チップの内側に付着し残存した分の量を排出することができないため正確に規定量を排出する方法として使用されています。
CD34陽性造血幹細胞やリンパ球サブセットでの絶対数測定においては、検体の分注量が結果に影響するため、正確に分注出来るリバース法が必須となります。
リバース法
- ピペットのプッシュボタンを2段目まで押し下げます。
- チップの先端を試料につけ、ゆっくりと試料を吸引します*1。
- プッシュボタンを1段目まで押し下げ、設定した量の試料を分注します*2。
- チップ内に残った試料は、チップとともに廃棄します。

*1:チップ外側に試料が付着していると、排出時に設定量以上が分注される可能性があるため、チップ外側を軽く拭き取ることでより正確な分注が可能となります。
*2:プッシュボタンを2段目まで押し下げますと、設定量以上が排出されてしまいます。排出は必ず1段目で止めます。
Q. 抗体を選択するうえでのコツを教えてください。
A. 抗体を選択するうえで注意するべき点としまして、1.対象となる抗原の発現量、2.蛍光色素の輝度が挙げられます。これらを考慮し、ご使用になる抗体を選択することで、より明確な結果を得ることができます。
1.抗原の発現量
図1では、各抗原の細胞表面上での発現量を示しています。このように抗原の発現量は一律ではなく、抗原の種類や発現する細胞によって異なっています。そのため、発現量の多い抗原と少ない抗原を同じ蛍光色素で染色しますと、その分離度に明確な違いが生じます(図2)。
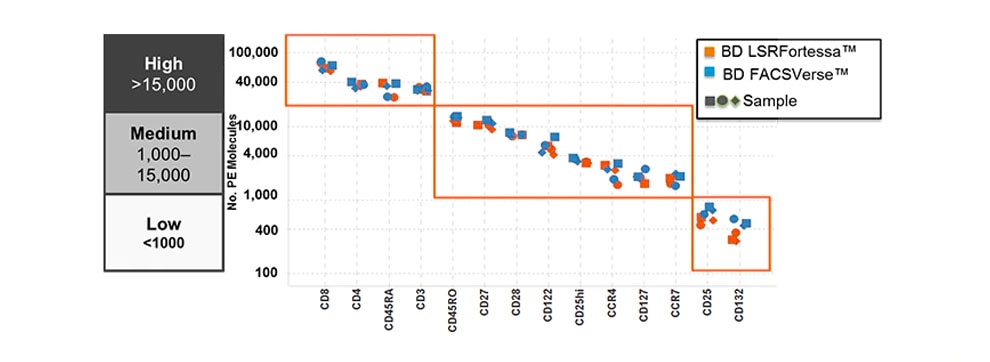
図1. 正常リンパ球における抗原と細胞表面上での発現量
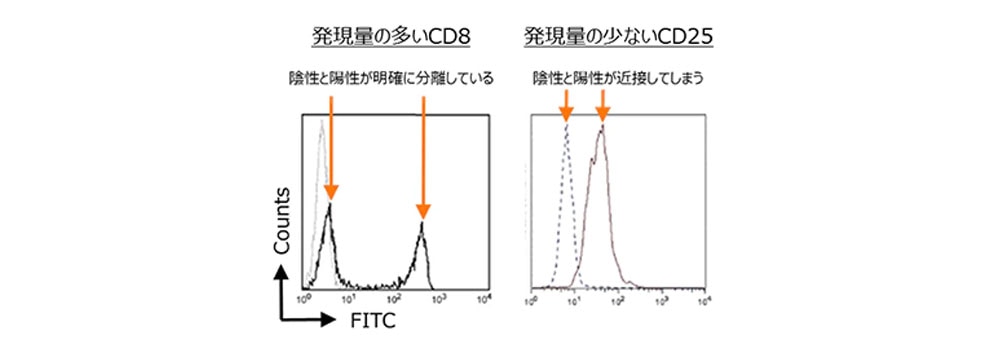
図2. 抗原発現量による陰性集団と陽性集団の分離度の違い
2.蛍光色素の輝度
より明確な結果を得るためには抗原発現量の違いを考慮して、蛍光色素を選択することが重要です。蛍光色素は、その種類によって輝度が大きく異なります。図3では各蛍光色素の輝度の違いを示しております。縦軸が輝度、横軸は蛍光色素の種類を示しています。これまで、一般的によく臨床検査の場で使用されてきました明るい蛍光色素としては、PEなどが挙げられます。
現在では、従来明るい色素として広く使われてきたPEの他にも、多くの明るい色素が登場しています。
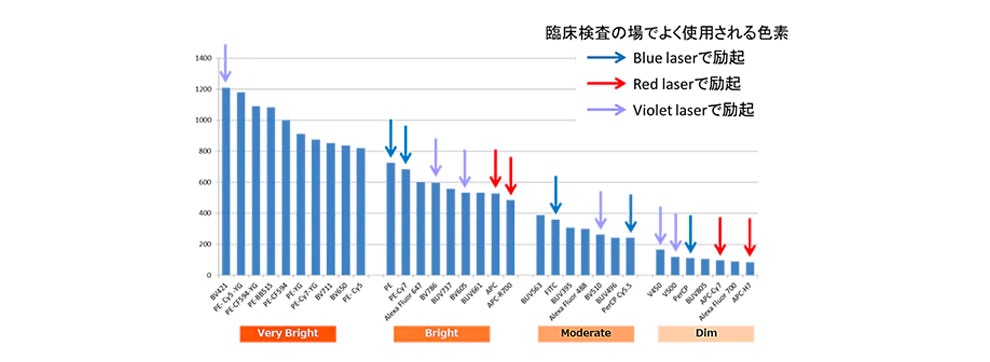
図3. 各蛍光色素の輝度
では、蛍光色素の輝度の違いは、どの程度測定結果に影響するのでしょうか?図4では同一抗原に対して異なる蛍光色素で染色した際の、結果の違いを示しています。この図では、横軸のCD197(CCR7)に対する蛍光標識のみ変更しております。上のプロット図(青字)では低輝度の蛍光色素を使用しておりますが、CD3陽性集団においてCD197陽性集団の分離が弱くなっています。さらに、CD3陰性集団においてはほとんどCD197陽性集団が見られません。一方、高輝度の蛍光色素で染色した下のプロット図(赤字)では、CD3陽性集団におけるCD197陽性集団の分離度合が改善され、より明確になっております。CD3陰性集団においても分離が明確となり、CD197陰性集団と陽性集団が存在していたことがわかります。
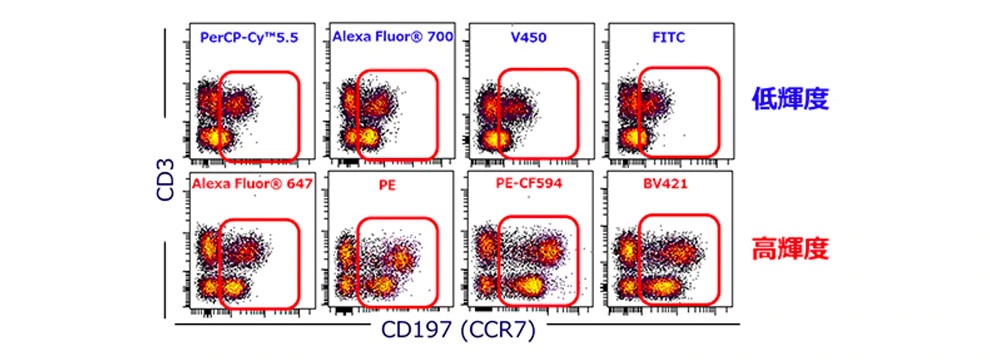
図4. 蛍光色素の違いによる測定結果への影響
このように蛍光色素の選択によっては、本来であれば異なる細胞集団でも十分に分離できないことがあります。特に、発現量が低い抗原、または集団ごとに同一マーカーの発現量が異なる場合に、用いる蛍光色素の選択が重要になってきます。低発現の抗原を検出する際には、高輝度の色素を使用することで、明確な結果を得ることができます。
図5では、蛍光色素の輝度と励起可能なレーザーをまとめております。発現量の低い抗原に対しては明るい色素を、発現量の高い抗原に対しては暗い色素を割り当てることで、明確な結果が得易くなります。下図をご参照いただき、目的の抗原をどの色素で染色するのが適当かを決める際の参考にしてください。
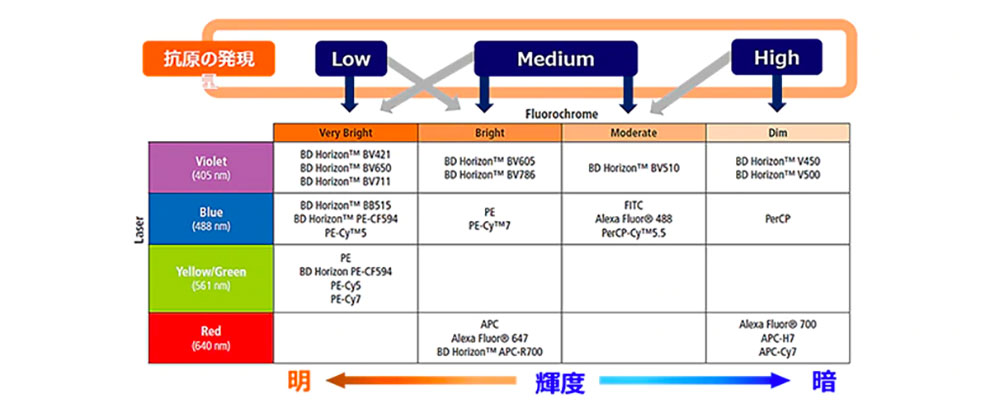
図5. 抗原発現量と蛍光色素の組み合わせ
3.実際の例
最後に抗原と蛍光色素の組み合わせについて、いくつか実際の例を挙げてご紹介いたします。
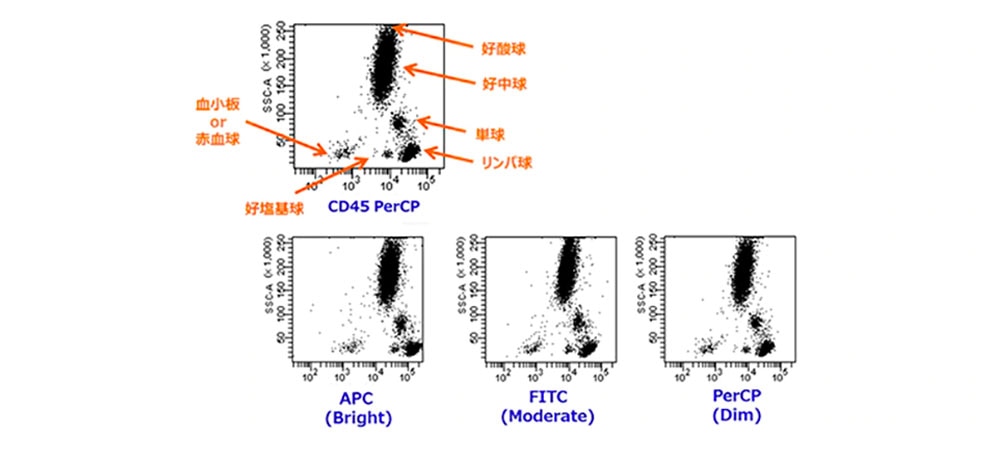
- CD45
白血球全般に発現するCD45は、集団によってその抗原量が異なっており、リンパ球 > 単球 > 顆粒球となっております。
CD45は抗原発現量が多い成熟リンパ球と弱陽性の芽球を分離しやすくするため、あえて輝度の低い(Dim)PerCPやAPC-H7などが選択されています。
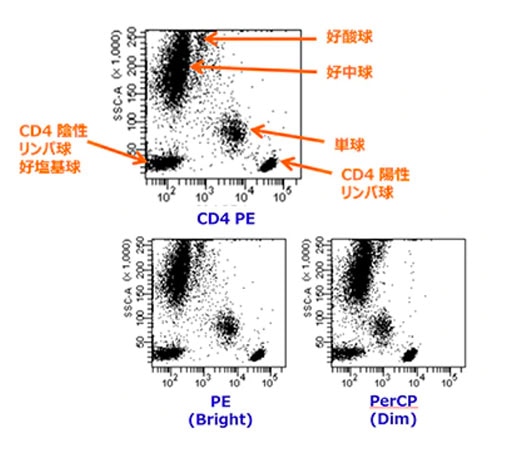
- CD4
CD4は、リンパ球の特定サブセット(ヘルパーT細胞)に発現しています。また、多くの胸腺細胞にも発現し、その場合しばしばCD8を共発現しています。また、CD4は単球にも発現しますが、その抗原密度はCD4陽性T細胞よりも低いものとなっています。
リンパ球においてはCD4の抗原発現量が多いため、Dimの蛍光色素でも問題ありません。しかし単球をターゲットとする場合には、抗原密度が低いためDimの蛍光色素を使用しますと、若干分離度が悪くなる可能性がございます
- CD3
CD3はT細胞レセプター(TCR)を構成する複合体の一部であり、単球や顆粒球には見られず、T細胞のみに発現するため、T細胞の代表的なマーカーとなっています。
CD3は抗原発現量が多いため、APC-H7のようなDimの色素でも十分な分離結果を得ることができます。しかし、PE-Cy™7やAPC-Cy™7、APC-H7*などのタンデム色素のCyanineは、色素自体が単球上のCD64に結合し、バックを上げることがありますので、注意が必要です。*APC-Cy7の類似物

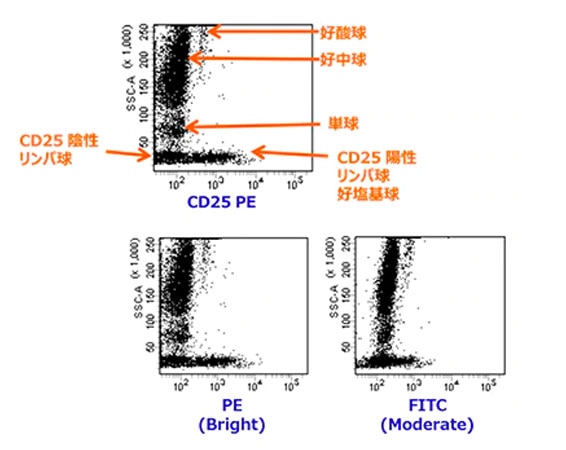
- CD25
CD25は活性化したT細胞やB細胞、活性化マクロファージ、好塩基球などに見られる抗原です。胸腺細胞や休止期のT細胞やB細胞には発現していません。造血器腫瘍解析では、活性化マーカーやTreg、ATLの検索などに使われています。
CD25は抗原の発現量が少ないため、FITCなどのModerateの蛍光色素ではBrightの色素に比べ、陰性化してしまう可能性がございます。
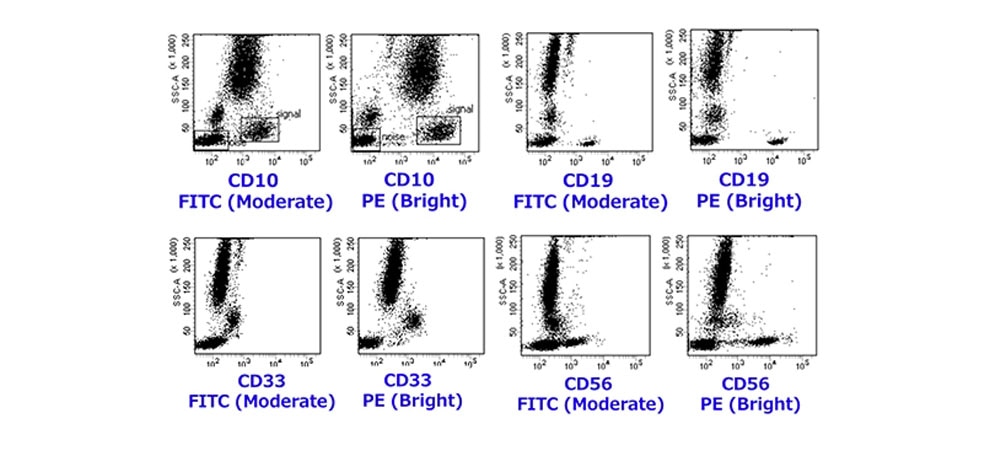
- 発現量の少ない抗原
ここでは他の発現量の少ない抗原についての具体例をご紹介させて頂きます。
CD10(下図では、末梢血に細胞株REHを加えたものをサンプルとして使用)やCD19ではModerateの蛍光色素を使用しますと、分離は出来ておりますが、その分離度合は弱いものとなっています。
CD33(単球)やCD56(NK細胞)におきましては、Moderateの色素ですと陰性集団との分離が極めて悪いものとなってしまっています。
そのため、こういった抗原につきましては、より輝度の高い蛍光色素の使用が推奨されます。
Q. 末梢血において溶血不良が起こりました。何が原因でしょうか?
A. 溶血不良の起こる原因として、1.溶血剤の温度、2.溶血比、3.検体由来などが考えられます。
1.溶血剤の温度
溶血剤には塩化アンモニウムベース(BD PharmLyse™ Lysing buffer)やジエチレングリコールベース(BD FACS™ Lysing Solution)のものなどがあります。
これらの溶血剤は、冷蔵保存していたものをそのまま使用すると、溶血不良の原因となる恐れがあります。
そのため、使用時には必ず室温(20-25℃)に戻してから使用してください。
2.溶血比
溶血比とは、溶血物(サンプル+モノクローナル抗体+溶血剤)に対する染色サンプルの容量(サンプル+モノクローナル抗体)の比率を指します。
溶血比は、次の式によって計算できます。
溶血比=溶血物の容量(サンプル+モノクローナル抗体+溶血剤)/ 染色サンプルの容量(サンプル+モノクローナル抗体)
サンプルによっては、8.0未満の溶血比では溶血不良となることがあります。
特にマルチカラー解析で、1チューブに多種の抗体を添加する場合には注意が必要です。
そのような場合には、下記のように溶血処理を複数回行うことが有効となる場合があります。
例:塩化アンモニウム溶血剤(2mL)添加 → 反応10 min → 遠心分離により上清を除去 → 塩化アンモニウム溶血剤(2mL)添加 → すぐに遠心洗浄
なお、BD FACS™ Lyse Wash Assistantをご使用の場合、DuoLyse(もしくはTriLyse)の使用を推奨しております。
3.検体由来
有核赤血球亢進症、骨髄線維症、鎌状赤血球貧血症、サラセミア、球状赤血球症など、サンプルによっては完全には溶血しない場合があります。
このような完全には溶血できないサンプルにおいては、CD45ゲーティングが有効な解析法になります。
CD45/SSCプロットにおいて、CD45陽性細胞のみをゲーティングすることで、測定時に入り込んだ赤血球を解析から外すことが可能になります(図1)。
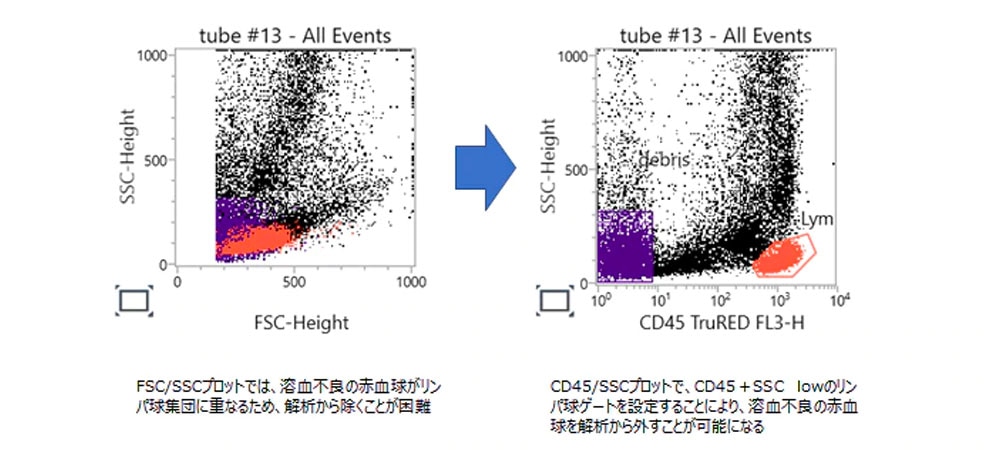
図1.CD45 gateの例
Q. 抗体のプレミックスを作製し、サンプル調製に使用しても大丈夫でしょうか?
A. プレミックス(カクテル抗体)して長時間保管すると、混ぜた抗体の濃度や種類によって、抗体凝集や遊離蛍光色素の結合などが生じることがあります。プレミックス抗体を作製する場合は、必ずシングルバイアルより調製したサンプルと同じ染色パターンになるかどうか、定期的(例:2週間毎)に比較検討し、使用可能期間を設定するようにしてください。
Q. アイソタイプコントロールの蛍光強度がサンプルよりも高くなってしまいました。原因は何でしょうか?
A. 抗体は製品によって含まれているタンパク質(抗体)量が異なっています。そのため理論的には、使用濃度と反応条件は必ずサンプルで使用する抗体と統一する必要があります。アイソタイプコントロールの抗体濃度が高くなっていることが原因で、非特異的反応が生じ、蛍光強度がサンプルより高くなっている可能性が考えられます。アイソタイプコントロールの濃度をご確認ください。
特に、細胞内抗原に対する抗体のアイソタイプコントロールでは、抗体染色後の洗浄を行っても余剰な抗体が除去されにくいため、抗体濃度を同レベルにする必要があります。細胞内抗原においては、抗体濃度の他に、分子量の大きい蛍光色素(PE)が非特異的染色を起こしやすいため、溶液中に単離したPE分子を削除した細胞内専用のPE アイソタイプコントロール(Cat.340013)の使用を推奨しています。
また、抗体はアイソタイプによって非特異的反応の起きやすさに差があります(IgG2aは非特異的反応が発生しやすいと言われています)。サンプルで使用する抗体とアイソタイプ(サブクラス)が異なっていると、蛍光強度に差が生じることもあります。なお、パネル内にIgG1, IgG2aなどが混在する場合は、理想的には両方のアイソタイプコントロールを立てるべきですが、非特異反応が起きやすいIgG2aをパネルのアイソタイプコントロールに採用しています。
Q. Fcレセプターへの抗体の非特異的反応をブロックする方法を教えてください。
A. Fcレセプターへの抗体の非特異的反応を防ぐ方法として、マウスFcレセプターの場合は、抗体のホスト動物の血清や抗Fcレセプター抗体(CD16/CD32)などのブロッキング剤(Mouse BD Fc Block Cat,553141) を添加し、抗体による非特異的反応をブロックする方法が一般的となっています。ヒトFcレセプターの場合は、マウスFcレセプターのように専用のブロッキング剤がなかったため、自家調製したヒト免疫グロブリン(または凝集ヒト免疫グロブリン)がブロッキングに使用されておりましたが、ヒトFcレセプターと結合する組み換えタンパク質によるブロッキング試薬“BD Fc Block™ Regent for Human” が弊社で開発され、市販化されています(製品情報は表1参照)。本製品を使用することにより、自家調製することなく、ヒトFc レセプターへの抗体の非特異的反応をブロックすることができます。
<BD Fc Block™ Regent for Humanによるブロッキング手順>
- 1×106細胞あたり2.5µg(5µL)のBD Fc Block™ Regent for Humanを添加します。
- 室温で10分間インキュベーションします。
- その後、通常通りの染色プロトコールで抗体反応を行ってください。
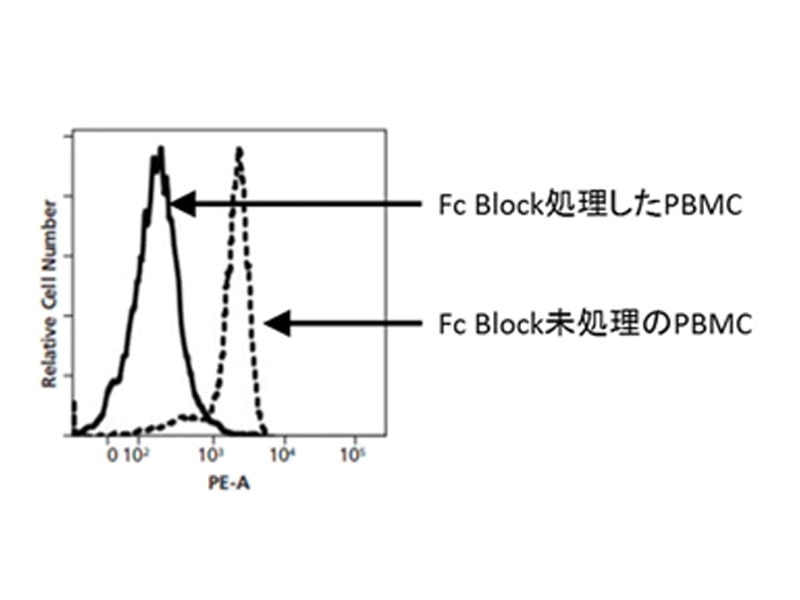
図1.Fcレセプターブロッキングの有無による非特異的反応の比較
末梢血単核細胞(PBMC)をBD Fc Block™ Regent for Humanで処理後、PE標識msIgG2aにて染色。
表1.BD Fc Block™ Regent for Human製品情報
| カタログ番号 | 商品名 | フォーマット | クローン | アイソタイプ | 反応性 | 容量 | 希望小売価格(円) |
|---|---|---|---|---|---|---|---|
| 564220 | BD Fc Block™ Reagent for Humnan | Purified | Fc1.3070 | Hu lgG1 | Hu | 250µg | 28,000 |
| 564219 | BD Fc Block™ Reagent for Humnan | Purified | Fc1.3070 | Hu lgG1 | Hu | 50µg | 10,000 |
Q. 非特異的反応にはどのような原因がありますか?
A. 抗体の非特異的反応の原因として、以下の3つが候補として考えられます(図1)。
- 細胞表面のFcレセプターへの非特異的結合
→Fcレセプターのブロッキング (Q. Fcレセプターへの抗体の非特異的反応をブロックする方法を教えてください。»をご参考ください) - 細胞のタンパク質との非特異的結合
→アイソタイプコントロールを使用し、バックグラウンドの影響を排除 (Q. アイソタイプコントロールの蛍光強度がサンプルよりも高くなってしまいました。原因は何でしょうか?»に留意してください) - 死細胞への非特異的結合
→死細胞染色試薬により、死細胞を解析から除去 (7-AADなどの死細胞染色剤で陽性になった集団を除外して、解析を行う手法)
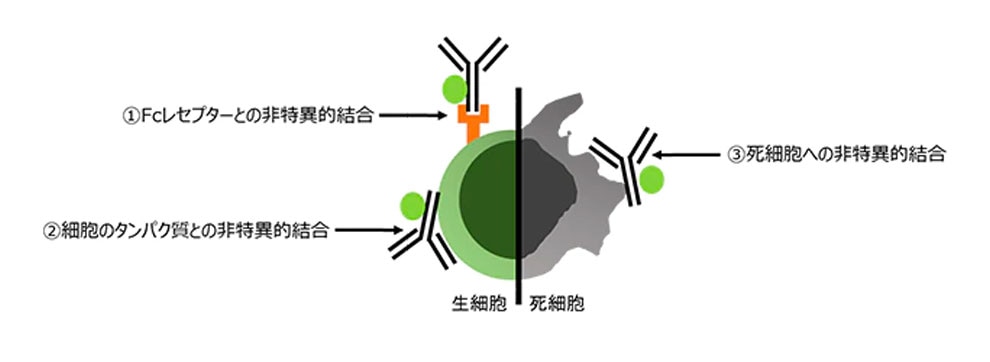
図1.抗体の非特異的反応の原因