-
Reagents
- Flow Cytometry Reagents
-
蛋白质印迹试剂
- 免疫分析 试剂
-
Single-Cell Multiomics Reagents
- BD® AbSeq Assay
- BD Rhapsody™ 附件试剂盒
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD® OMICS-Guard Sample Preservation Buffer
- BD Rhapsody™ ATAC-Seq Assays
- BD® OMICS-One Protein Panels
- BD OMICS-One™ WTA Next Assay
-
Functional Assays
-
显微成像试剂
-
Cell Preparation and Separation Reagents
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

风湿病研究
类风湿性关节炎(RA)、狼疮和多发性硬化等风湿性疾病是由自身免疫反应引起。在免疫缺陷疾病中,免疫系统不能引发适当的免疫反应,而在自身免疫性疾病中,免疫系统对自身抗原的反应过度。无法区分自身抗原和非自身抗原的原因在于免疫耐受被破坏,免疫系统拥有防止自身攻击的机制。1 自身免疫可能影响特定组织,也可能会对全身产生影响(狼疮)。一般认为,强直性脊柱炎等某些疾病属于自身免疫性和炎性关节炎疾病。
风湿性疾病临床研究实例
类风湿性关节炎(RA)是一种自身免疫性疾病,其表现为全身关节(包括手和脚)的炎症和损伤,影响约0.5%~1%的群体,在美国,女性的患病率大于男性2。
全身性红斑狼疮(SLE)是一种慢性炎症性自身免疫性疾病。它通过产生自身抗体来影响多个器官系统,如皮肤、肾脏、肺和中枢神经系统3。
强直性脊柱炎(AS)是一种由多种基因引起的轴向肌肉骨骼系统的慢性进行性炎症性风湿性疾病4。
类风湿性关节炎
类风湿性关节炎的类型
类风湿性关节炎可分为两类:
- 抗瓜氨酸蛋白抗体(ACPA)阳性
- 抗瓜氨酸蛋白抗体(ACPA)阴性
在炎症发生过程中,氨基酸精氨酸通过肽酰基精氨酸脱氨酶(PAD)转化为瓜氨酸。这一过程称为瓜氨酸化,诱导抗体的形成,基本可以在几年内诊断类风湿性关节炎不断发展的固定指标。5 与阴性型相比,抗瓜氨酸蛋白抗体阳性型更具侵袭性。6
从免疫学角度来看类风湿性关节炎的进展
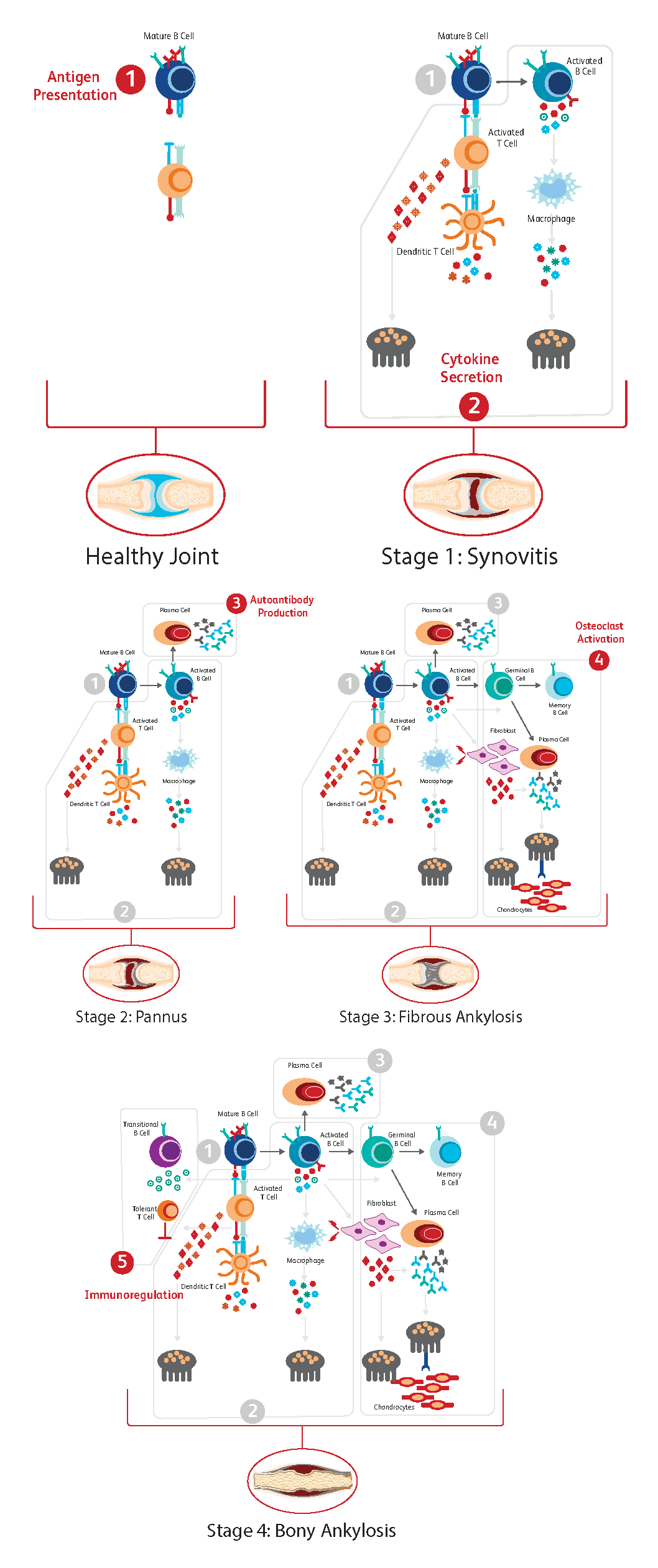
类风湿性关节炎会逐步恶化,并且会随之发生一系列的免疫事件。7 这一过程分为以下五个步骤:
1. 抗原提呈
滑膜炎症是由CD4 T细胞和巨噬细胞浸润驱动的。成熟的B细胞和树突状细胞将抗原提呈给T细胞,从而导致T细胞活化,并分化为促炎性细胞因子,产生效应T细胞,进而刺激巨噬细胞细胞因子的产生。
2. 细胞因子分泌
紧接着会出现细胞因子分泌,不同的免疫细胞会分泌特有的细胞因子。
B细胞:白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)以及白细胞介素-17(IL-17)
T细胞:IL-17和TNF-α
巨噬细胞:IL-1、IL-6以及TNF-α
纤维母细胞及T细胞:核因子配体受体激活剂(RANKL)
这些细胞因子共同刺激破骨细胞分化所必需的TRANCE/RANKL的表达。
3. 自身抗体产生
B-T细胞相互作用导致负责自身抗体产生和分泌的血浆细胞发生活化与分化。产生抗IgG的自身抗体(例如,类风湿因子和抗瓜氨酸蛋白抗体)。
4. 破骨细胞活化
自身抗体、细胞因子和RANKL刺激破骨细胞,导致骨吸收,并诱发软骨细胞驱动的软骨损伤。破骨细胞的丰度以及加速的骨损伤由B细胞进一步驱动——因为能够识别瓜氨酸波形蛋白的浆细胞源性自身抗体会促进单核细胞向破骨细胞的分化。
5. 免疫调节
与活化的B细胞相比,过渡性B细胞可以通过提供IL-10和其他机制,以免疫调节的方式抑制破骨细胞的形成。
类风湿性关节炎、系统性红斑狼疮以及AS的遗传基础
遗传因素对类风湿性关节炎有显著影响。 尤其是人类白细胞抗原(HLA)位点占类风湿性关节炎遗传易感性的50%左右,HLA-DRB1是一种主要的组织相容性复合体(MHC)II类分子,在不同种细胞群中有多个HLA-DRB1等位基因脱氨酶4型(PADI4)和IL-2受体亚基α也与类风湿性关节炎有关。
系统性红斑狼疮是一种多基因参与的复杂遗传病。HLA II类DRB也与系统性红斑狼疮有关。3,8
HLA-B27是一种MHC I类分子,与AS强烈相关。HLA-B27检测是AS筛查的常规方法。4
BD Biosciences类风湿性关节炎研究工具
BD Horizon™ Dri Treg Panel 经过预分装、预配置及干燥,含有用于表征与自身免疫研究直接相关的FoxP3+原初、过渡及效应调节性T细胞亚群的标记物。
BD Horizon™ Dri TBNK + CD20 Panel可有效表征T细胞、B细胞及NK细胞。
BD Horizon™ Dyes及BD Horizon™ Antibodies是表征表面受体较少的免疫细胞的理想材料,较高的亮度让您很容易就能从样本中的其他细胞中区分出这些暗淡的细胞。
参考
- Wang L, Wang F, Gershwin ME. Human autoimmune diseases: a comprehensive update. J Intern Med. 2015;278(4):369-395. doi: 10.1111/joim.12395
- Hunter TM, Boytsov NN, Zhang X, Schroeder K, Michaud K, Araujo AB. Prevalence of rheumatoid arthritis in the United States adult population in healthcare claims databases, 2004-2014. Rheumatol Int. 2017;37(9):1551-1557. doi: 10.1007/s00296-017-3726-1
- Baechler EC, Batliwalla FM, Karypis G, et al. Interferon-inducible gene expression signature in peripheral blood cells patients with severe lupus. Proc Natl Acad Sci U S A. 2003;100(5):2610-2615. doi: 10.1073/pnas.0337679100
- Dakwar E, Reddy J, Vale FL, Uribe JS. A review of the pathogenesis of ankylosing spondylitis. Neurosurg Focus. 2008;24(1):E2. doi: 10.3171/FOC/2008/24/1/E2
- Van Gaalen FA, Linn-Rasker SP, van Venrooij WJ, et al. Autoantibodies to cyclic citrullinated peptides predict progression of rheumatoid arthritis in patients with undifferentiated arthritis: A prospective cohort study. Arthritis Rheum. 2004;50:709-715. doi: 10.1002/art.20044
- Chung IM, Ketharnathan S, Thiruvengadam M, Rajakumar G. Rheumatoid arthritis: the stride from research to clinical practice. Int J Mol Sci. 2016;17(6):900. doi: 10.3390/ijms17060900
- Smolen JS, Aletaha D, Barton A, et al. Rheumatoid arthritis. Nature Rev Dis Primers. 2018;4:18001. doi: 10.1038/nrdp.2018.1
- Parodis I, Stockfelt M, Sjowall C. B cell therapy in systemic lupus erythematosus: From rationale to clinical practice. Front Med (Lausanne). 2020;7:316. doi: 10.3389/fmed.2020.00316
仅供研究使用,不用于诊疗程序。