-
Reagents
- Flow Cytometry Reagents
-
蛋白质印迹试剂
- 免疫分析 试剂
-
Single-Cell Multiomics Reagents
- BD® AbSeq Assay
- BD Rhapsody™ 附件试剂盒
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD® OMICS-Guard Sample Preservation Buffer
- BD Rhapsody™ ATAC-Seq Assays
- BD® OMICS-One Protein Panels
- BD OMICS-One™ WTA Next Assay
-
Functional Assays
-
显微成像试剂
-
Cell Preparation and Separation Reagents
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

磁性分离
细胞分离是一种强大的技术,也是基础和临床研究应用不可或缺的工具。生物细胞群的异质性往往使得分离单个细胞类型成为必需,以进行更为深入的研究。传统的细胞分离是根据细胞的物理特性进行的,这些物理特性包括粘附性、大小、密度、对静电力或磁力的亲和力。生物化学特性,如表面抗原的表达,也可用于细胞分离。
什么是磁性细胞分离?它是如何实现的?
这种细胞分离技术利用的是带有磁珠标记抗体的标记细胞表面标记物的潜力,以及磁场迁移标记粒子的能力。1 这种由磁力(磁电泳)控制的迁移在分离异质细胞群方面是非常有用的,并且是磁激活细胞分选(MACS)的基础。细胞可以用基于管或基于柱的方法进行分离。2
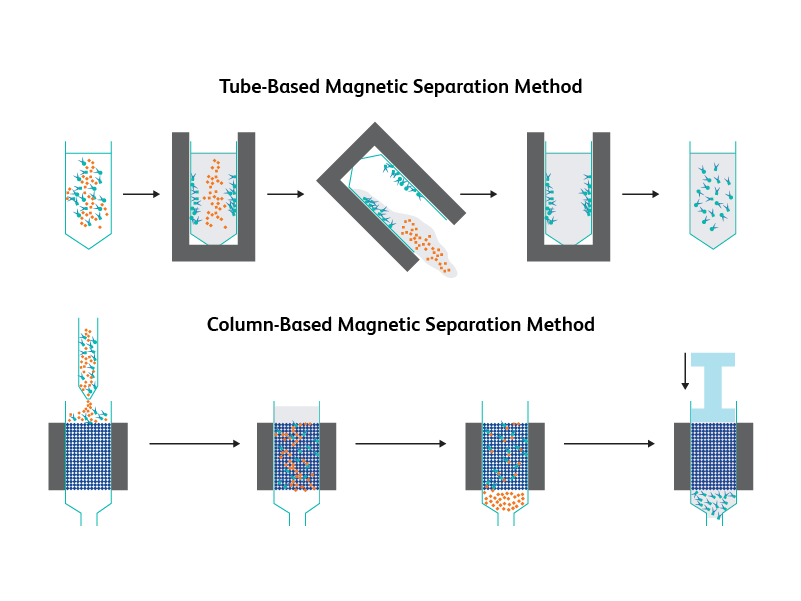
在基于管的磁性分离方法中,将磁性标记细胞的悬浮体放置在磁铁中,允许标记细胞移动,随后它们可以被分离。
在基于柱的磁性分离方法中,磁性标记细胞的悬浮体通过磁铁内的柱被分离,捕获标记细胞,随后它们可以被分离。
正向细胞选择与负向细胞选择
基于被保留或隔离的内容,可以选择两种类型:
- 正向细胞选择
- 负向细胞选择
什么是正向细胞选择?为什么它很重要?
正向选择是选择需要收集的细胞作为目标群体。该方法使用带有抗体的磁性粒子,这些抗体以共价结合在其表面的兴趣亚群为靶向。一旦放置在磁铁内,细胞将朝磁铁迁移,并保留在磁场内,而未标记的细胞则被取出并丢弃。然后,靶细胞可以被收集,并在从磁场中移除后用于所需的应用。
正向细胞选择在所选定细胞的纯度、回收率和活性方面产生良好的结果。然而,根据被选择的细胞类型和被颗粒靶向的表面抗原,正向选择可导致细胞被激活或发生功能改变。即使激活的可能性很低,如果您特别需要纯化但未受刺激的细胞,这种由磁粒子诱导的激活可能是一个问题。在这种情况下,您应该考虑采用负向选择来进行细胞分离。
什么是负向细胞选择?为什么它很重要?
负向选择是磁隔离不需要的细胞,而靶细胞群可在下游应用(如细胞分选)之前被抽吸和收集。
通过消耗或负向选择而进行的富集,用于要求细胞群具有高纯度且表面没有抗体或粒子附着的研究应用。
在这个过程中,所有的多余细胞首先被标记为含有针对其所表达抗原的单克隆抗体的混合剂。在洗去未结合的抗体后,第二步试剂被用来对这些细胞进行磁性标记。被标记的细胞迁移到磁铁上,在悬浮液中留下一个纯净的、未受影响的待收集细胞亚群。大部分(大于>95%)多余的细胞群可以通过负向选择被去除。1
推荐在下游单细胞多组学分析中使用负向选择富集。这样的预富集有助于最小化对细胞的操纵。
分选前的预富集
在分选前对细胞进行富集,有利于获得更快、更好的分选结果,对于非常罕见的细胞群尤其如此。在这个过程中,首先通过负向选择来富集感兴趣的细胞。该过程可以去除20-80%的多余细胞,从而富集感兴趣的未受影响细胞群,并使细胞分选更快、更有效。
采用磁性细胞分离的主要考虑因素是什么?
细胞分离的结果由以下三个因素决定:
- 靶细胞纯度
- 靶细胞回收率
- 细胞活性
靶细胞纯度
在异质细胞群中收集的靶细胞与非靶细胞的百分比决定了收集的靶细胞组分的纯度。
靶细胞回收率
分选后得到的靶细胞占原细胞悬液中靶细胞总数的百分比决定了回收率。
细胞活性
活性是指存活细胞百分比,可以反映分离后的细胞质量。
参考
- Plouffe BD, Murthy SK, Lewis LH. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Rep Prog Phys. 2015;78(1):016601. doi: 10.1088/0034-4885/78/1/016601
- Tomlinson MJ, Tomlinson S, Yang XB, et al. Cell separation: Terminology and practical considerations. J of Tissue Eng. 2013;4:2041731412472690. doi: 10.1177/2041731412472690
BD生物科学公司的磁性分离产品系列
BD生物科学公司提供了多种试剂和强力磁体用于磁性细胞分离。
我们的产品系列包括 用于正向细胞选择和负向细胞选择的精选磁性分离试剂。. 有富集B淋巴细胞,CD4和CD8 T淋巴细胞,自然杀伤细胞细胞和某些类型的小鼠树突状细胞的试剂。
BD生物科学公司的磁性分离工作流程规程
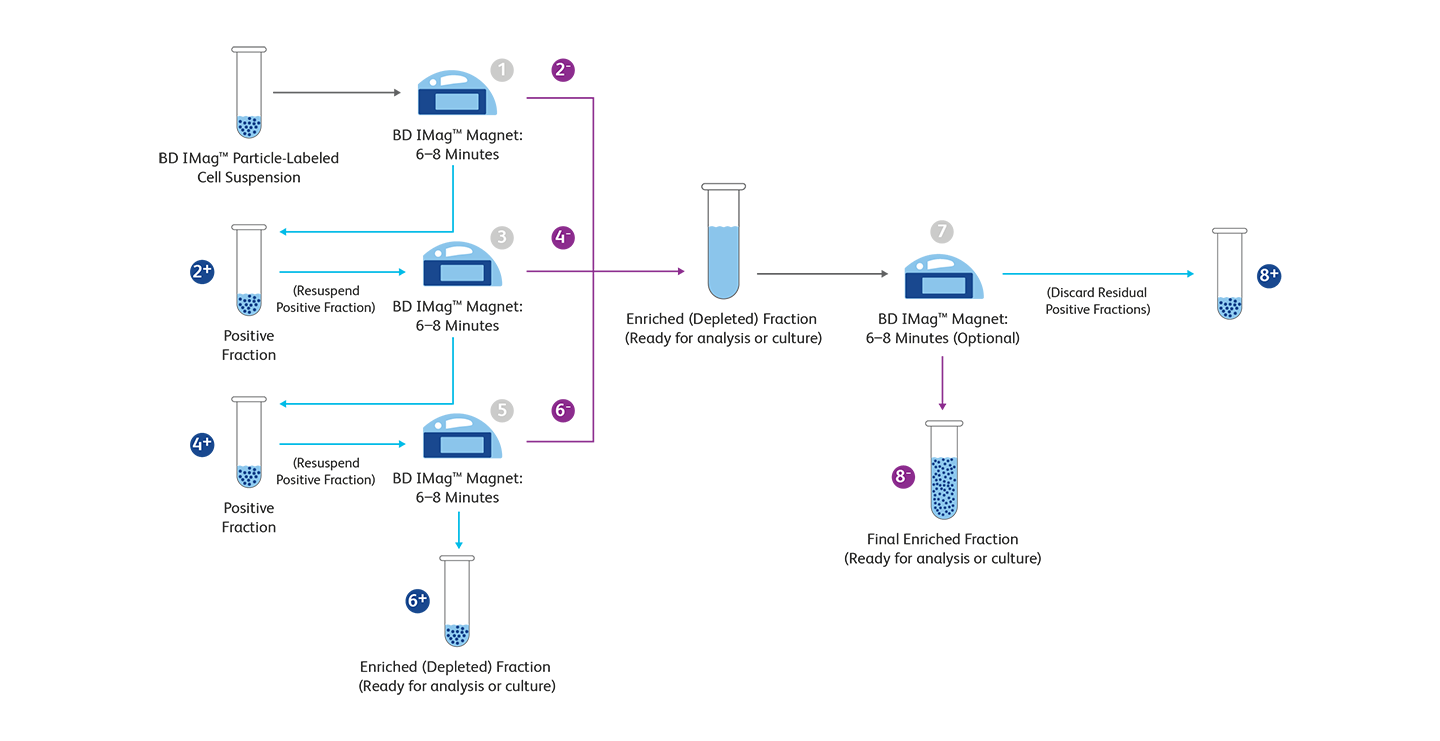
| Step | Positive Selection (+) | Negative Selection (–) |
|---|---|---|
| 1 | Place the BD IMag™ Particle-labeled cell suspension onto the BD IMag™ Magnet. | Place the BD IMag™ Particle-labeled cell suspension onto the BD IMag™ Magnet. |
| 2 | Remove the tube containing the positive fraction. | Remove the supernatant containing the negative fraction and place in an appropriately labeled tube. |
| 3 | Resuspend the positive fraction and place it back onto the BD IMag™ Magnet. | Resuspend the positive fraction and place it back onto the BD IMag™ Magnet. |
| 4 | Remove the tube containing the positive fraction. | Remove the negative fraction and pool with the negative fraction from step 2. |
| 5 | Resuspend the positive fraction and place it back onto the BD IMag™ Magnet. | Resuspend the positive fraction and place it back onto the BD IMag™ Magnet. |
| 6 | Remove the positive fraction and resuspend the cells for use. | Remove the negative fraction and pool with the negative fraction from steps 2 and 4. |
| 7 | Place the combined negative fractions on the BD IMag™ Magnet. | Place the combined negative fractions on the BD IMag™ Magnet. |
| 8 | Remove and discard residual positive fraction. | Remove remaining twice-enriched fraction and place in an appropriately labeled tube for use. |
+ and – refer to the steps in the positive and negative selection process, respectively.
使用BD生物科学公司的磁性分离试剂所生成的样本数据
正向或负向选择后活化标志物CD25和CD69的表达
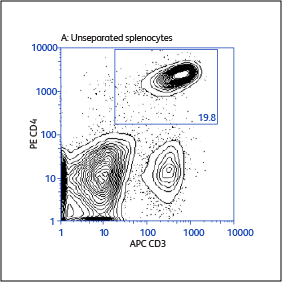
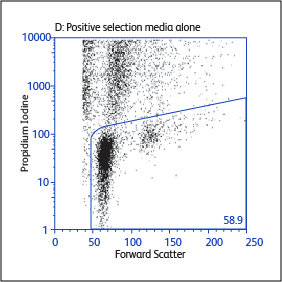
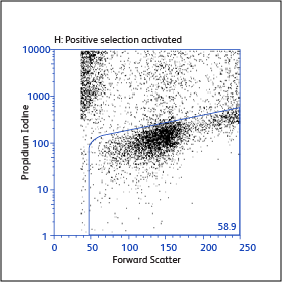
分别使用BD IMag™ 小鼠 CD4 Particles–DM和BD IMag™ 小鼠 CD4 T淋巴细胞富集Set–DM对CD4 T细胞进行正向或负向选择(富集)后活化标志物CD25和CD69的表达
显示富集规程之灵活性的数据
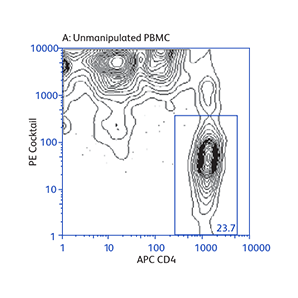
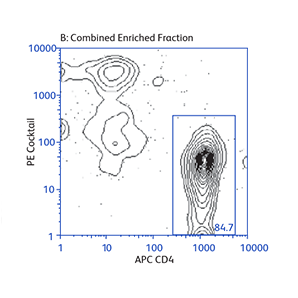
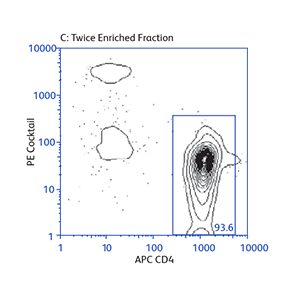
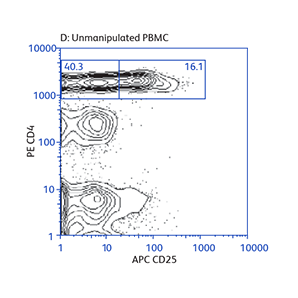

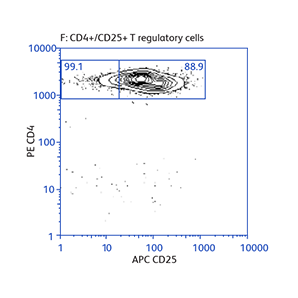
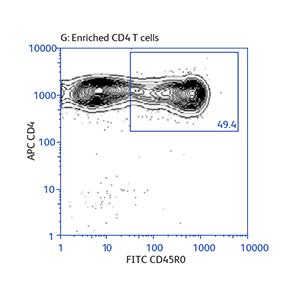
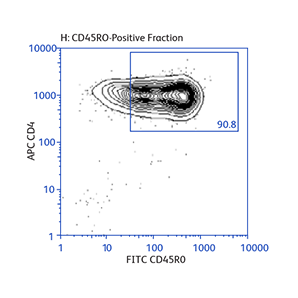
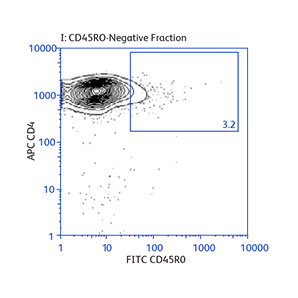
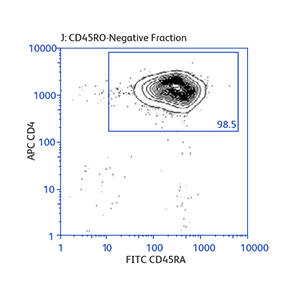
演示如何根据不同的实验需要来操作基本的富集规程,以及如何将正向选择与富集结合起来分离罕见的细胞亚群。
仅供研究使用,不用于诊疗程序。