-
Reagents
- Flow Cytometry Reagents
-
蛋白质印迹试剂
- 免疫分析 试剂
-
Single-Cell Multiomics Reagents
- BD® AbSeq Assay
- BD Rhapsody™ 附件试剂盒
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD® OMICS-Guard Sample Preservation Buffer
- BD Rhapsody™ ATAC-Seq Assays
- BD® OMICS-One Protein Panels
- BD OMICS-One™ WTA Next Assay
-
Functional Assays
-
显微成像试剂
-
Cell Preparation and Separation Reagents
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

T细胞
随着我们对T淋巴细胞在清除病原体过程中的作用、T淋巴细胞在免疫治疗中的应用以及T淋巴细胞失调与多种疾病之间关系的认识日益加深,所以在过去的十年中,T淋巴细胞一直是热点,处于研究的前沿位置。一个重要的例子是T细胞的耗损,这是由于例如人类免疫缺陷病毒(HIV)等感染和获得性免疫缺陷综合症(艾滋病)等严重继发性免疫缺陷而引起的。1在健康人体内,成熟的T细胞和T调节性细胞(Tregs)有助于维持外周免疫耐受,防止自身抗原引起自身免疫应答。最近,研究兴趣转向针对T细胞受体的免疫检查点抑制剂,比如PD-1和CTLA-4,已经成功地在肿瘤微环境中解除了对T细胞激活的抑制以及经抗原刺激的T细胞增殖的抑制。这一策略已经成功应用于治疗黑色素瘤以及其他肿瘤。2嵌合抗原受体(CAR-T细胞(例如:抗CD19 CAR-T细胞)在治疗B细胞恶性肿瘤(如急性淋巴细胞白血病)方面非常成功(应答约为93%)。2流式细胞仪,不仅为T细胞的免疫表型和分析提供了一个强大的工具,而且进一步加深了对这些领域的理解。
T细胞的起源和发育
T细胞起源于骨髓,然后转移到胸腺中发育成熟。T细胞的特征标记物是其T细胞受体(TCR)以及TCR复合体中的CD3。按照其它表面分子的表达,它们还可以进一步被细分为两种主要类型:CD4(CD4+或辅助性T细胞)和CD8(CD8+或细胞毒性T细胞)。3
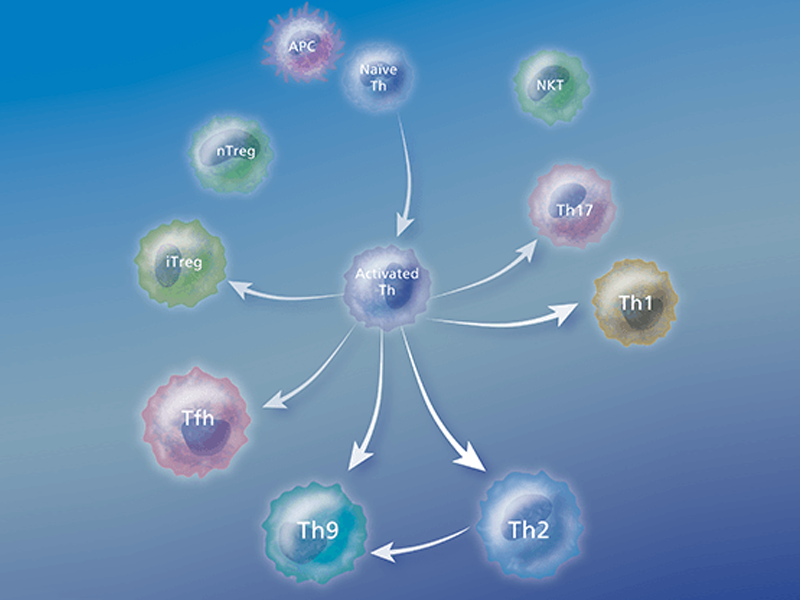
T细胞的类型
辅助性T细胞
辅助性T细胞(Th),是适应性免疫应答和炎症性疾病的重要调节因子。作为淋巴细胞的一个亚群,辅助性T细胞对于免疫系统的建立以及功能的完善非常重要。这种细胞的特殊之处在于,虽然它们几乎没有或根本没有细胞溶解或吞噬活性。但是,它们却可以激活并且指导其他免疫细胞。
在一些专职的抗原呈递细胞(APCs)比如树突状细胞、巨噬细胞以及B细胞的激活下,抗原特异性的CD4+T细胞会依据细胞膜表达或分泌的细胞因子和效应分子,以及它们各自的效应功能,分化成为效应细胞。已经识别的几种Th细胞类型:
Th1细胞
Th1细胞参与细胞免疫应答以及宿主抵御细胞内病原体。这种分子的特征是,产生促炎性细胞因子,比如IFN-γ、 IL-2和淋巴毒素-α(LTα)。Th1细胞主要参与细胞介导免疫。Th1细胞产生的细胞因子,刺激巨噬细胞和其他淋巴细胞来吞噬和破坏微生物病原体。几种慢性炎症性疾病,被认为主要是由Th1引起的,包括多发性硬化症、糖尿病和类风湿性关节炎。
Th2细胞
Th2细胞参与体液免疫应答以及宿主抵御细胞外病原体(如寄生虫)。这种细胞是以产生IL-4、IL-5、IL-6、IL-10和IL-13为特征的。认为Th2细胞在过敏反应中发挥作用。像IL-4这样的细胞因子,通常刺激产生针对大型细胞外寄生虫的抗体,而IL-5则刺激嗜酸性粒细胞对大型细胞外寄生虫产生应答。过敏和萎缩主要是由Th2导致的。Th2细胞历来被认为是IL-9的来源。然而,最近发表的论文,发现存在一种与Th2相关细胞类型,其以分泌IL-9和IL-10为特征。这种所谓的Th9细胞,既可以在TGF-β存在的情况下与Th2细胞分化,也可以在IL-4和TGF-β联合作用下与初始CD4细胞分化。这种细胞可能与哮喘和组织炎症有关。
Th1和Th2细胞之间的平衡
当Th1细胞产生IFN-γ时,这会促使巨噬细胞产生TNF和有毒的氧气,从而破坏吞噬体和溶酶体内的微生物。而另一方面,当Th2细胞产生IL-4和IL-10时,这种细胞因子阻断了由IFN-γ激活的微生物杀伤作用。对Th1/Th2之间关系,还进行了移植方面的研究。Th1应答与大多数形式的急性移植物或移植物排斥反应和移植物抗宿主病(GVHD)有关,而Th2应答与保护性或慢性排斥反应有关。然而,克隆的Th1或Th2细胞在实验模型中有类似的排斥皮肤移植的能力,并且现在Tr1/Treg细胞与保护和耐受性诱导相关。同时,胎儿类似于一个同种异体移植物,并且认为Th2或Treg应答具有保护性,而Th1可能导致再吸收或自然流产。4
Th17细胞
Th17细胞参与炎症应答以及宿主抵御细胞外病原体。Th17细胞是一种辅助性T细胞,可以产生IL-17A, 而Th17细胞已被证明在诱导自身免疫组织损伤中发挥重要作用。它们与Th1或Th2细胞不同,因为它们不产生经典的Th1或Th2细胞因子(如IFN-γ或IL-4)。它们在小鼠自身免疫模型中发挥关键作用,有研究表明,从初始T辅助细胞到Th17细胞的分化途径涉及TGF-β和IL-6的结合。RORγt是一项关键转录因子,其参与Th17细胞的诱导。IL-6或TGF-β可以诱导部分RORγt表达,但是Th17细胞的生成需要TGF-β和IL-6。
而且,有人认为IL-6和TGF-β在稳定状态下的相对平衡,会打破有助于Th17或Treg在不同组织中进行分化的平衡。Th17亚群的诱导需要TGF-β和IL-6,而IL-17A所产生细胞的扩增则依赖TGF-β和IL-21。Th17应答的维持,主要依赖于IL-23(p19/p40)。IL-23与IL-23受体结合,触发下游STAT3激活,随后上调ROR-γ并且产生IL-17A。
由于IL-17A可以诱导许多促炎性因子(比如TNF、IL-6和IL-1β),因此有人认为Th17细胞可能与自身免疫性疾病(比如实验性自身免疫性脑脊髓炎(EAE)和结肠炎)的发生和/或发展有关。
调节性T细胞
调节性T细胞(Tregs)在维持机体免疫平衡方面具有非常重要的作用。2 Treg通过抑制其他T细胞的功能,从而限制免疫应答。在一些自身免疫性疾病,比如多发性硬化症、活动性类风湿关节炎和I型糖尿病等,Tregs的数量及功能均会发生变化。在许多恶性疾病(比如肺癌、胰腺癌和乳腺癌等)已经发现Tregs明显增高。Treg还会阻断抗肿瘤免疫应答,5从而导致死亡率上升。
随着关于调节性T细胞(Tregs)免疫抑制潜能方面公布数据的增加,人们对其潜在应用的热情也越来越高。因此,关于的Treg研究非常活跃,几乎每天都有新的论文发表。目前,常用的Treg鉴定、分离和表征的标记物有CD4、CD25、CD127以及FoxP3。然而,具有功能性意义的新靶标(比如CD39、CD45RA、CTLA-4等)正在迅速涌现。
CD4和CD8 Tregs
迄今为止,Tregs已经确定的两个主要类别为:CD4 Tregs和CD8 Tregs。CD4 Tregs可以分为两类:一类是天然Tregs(nTregs),其表达CD25和FoxP3;另一类是所谓的适应性或诱导性Tregs(iTregs)。
天然Tregs源自于胸腺的CD4+细胞,该细胞表达CD25的强阳性并且表达转录因子(以及谱系标记物)FoxP3。 nTregs约占CD4+T细胞总数的5~10%,并可以在T淋巴细胞发育的单阳性阶段首先出现。6,7由于具有与自身抗原的高亲和力,从而它们被阳性选择。该信号发育成为Treg细胞的过程,被认为是通过T细胞受体和胸腺基质细胞上的带有自身抗原肽的MCH-II复合体相互作用进行传递的。5 nTregs本质上属于细胞因子非依赖型。
适应性或诱导性Tregs来源于胸腺CD4单阳性细胞。它们分化为CD25和FoxP3表达的Tregs(iTregs),需要有足够的同源抗原和特异性免疫调节细胞因子(比如TGF-β、IL-10和IL-4.8)的刺激。
FoxP3是目前最特异的Tregs标记物,9尽管有关于FoxP3-Tregs小细胞群的报道。转录因子FoxP3作为Tregs标记物的发现,使科学家们能够更好地确定Tregs细胞群,从而发现包括CD127在内的其他Tregs标记物。10
CD127细胞
CD127是异构IL-7受体的一部分,而异构IL-7受体是由CD127和通用γ链组成的,γ链在其他细胞因子受体(IL-2R、IL-4R、IL-9R、IL-15R和IL-21R)中也存在。CD12在胸腺细胞、T细胞和B祖细胞、成熟T细胞、单核细胞以及一些其他的淋巴细胞和骨髓细胞上进行表达。有研究显示,IL-7R在成熟T细胞的增殖和分化中发挥着重要作用,并且体外实验表明,CD127的表达随着T细胞活化而下调。11有人认为FoxP3与CD127启动子相互作用,从而降低Tregs中CD127的表达。
参考
- McCune JM. The dynamics of CD4+ T-cell depletion in HIV disease. Nature. 2001;410(6831):974-979. doi: 10.1038/35073648
- Todryk S, Jozwik A, de Hayilland J, Hester J. Emerging cellular therapies: T cells and beyond. Cells. 2019;8:284. doi:10.3390/cells8030284
- Mousset CM, Hobo W, Woestenenk R, Preijers F, Dolstra H, van der Waart AB. Comprehensive phenotyping of T cells using flow cytometry. Cytometry A. 2019;95(6):647-654. doi:10.1002/cyto.a.23724
- Qian J, Zhang N, Lin J, et al. Distinct pattern of Th17/Treg cells in pregnant women with a history of unexplained recurrent spontaneous abortion. Biosci Trends. 2018;12(2):157-167. doi:10.5582/bst.2018.01012
- Overacre-Delgoffe AE, Chikina M, Dadey RE, et al. Interferon-γ drives Treg fragility to promote anti-tumor immunity. Cell. 2017;169(6):1130-1141.e11. doi:10.1016/j.cell.2017.05.005
- Workman CJ, Szymczak-Workman AL, Collison LW, Pillai MR, Vignali DA. The development and function of regulatory T cells. Cell Mol Life Sci. 2009;66(16):2603-2622. doi:10.1007/s00018-009-0026-2
- Schiavon V, Duchez S, Branchtein M, et al. Microenvironment tailors nTreg structure and function. Proc Natl Acad Sci U S A. 2019;116(13):6298-6307. doi:10.1073/pnas.1812471116
- Liu M, Li S, Li MO. TGF-β control of adaptive immune tolerance: a break from Treg cells. Bioessays. 2018;40(11):e1800063. doi:10.1002/bies.201800063
- Lu L, Barbi J, Pan F. The regulation of immune tolerance by FOXP3. Nat Rev Immunol. 2017;17(11):703-717. doi:10.1038/nri.2017.75
- Rodríguez-Perea AL, Arcia ED, Rueda CM, Velilla PA. Phenotypical characterization of regulatory T cells in
humans and rodents. Clin Exp Immunol. 2016;185(3):281-291. doi:10.1111/cei.12804
- Di Caro V, D'Anneo A, Phillips B, et al. Interleukin-7 matures suppressive CD127(+) forkhead box P3(FoxP3)
(+) T cells into CD127(-) CD25(high) FoxP3(+) regulatory T cells. Clin Exp Immunol. 2011;165(1):60-76.
doi: 10.1111/j.1365-2249.2011.04334.x
BD生物科学公司为T细胞的研究,提供了全面的试剂和试剂盒组合。
在研究T细胞的方法中,多色流式细胞仪是最常用的方法之一,因为它可以对高度复杂的T细胞亚群进行表征,无论是功能上还是表型上。补充医学技术,比如ELISA(酶联免疫吸附测定法)、 ELISPOT(酶联免疫斑点测定法)和基于微球的免疫测定法,也进一步促进了T细胞领域的研究,同时,补充医学技术提供了灵活性,从而可以满足一系列的实验需求和通过多种方法来验证结果。
下表列出了支持您进行T细胞研究所需工具和技术的重要特征,并且帮助您找到满足您的实验需求的工具和技术。某些技术可以揭示关于某个样品的特定信息,或者可以更好地满足您的实际需要,比如可以使用的仪器或样品类型。在某些情况下,研究人员可以使用多种技术的组合信息来验证结果。不同的方法可以描绘出T细胞发育促进机制的详细画面。
| 工具/技术 | 流式细胞术:表面 | 流式细胞术:细胞内 | BD™ Cytometric Bead Array (CBA) | ELISPOT | ELISA法 | 体内捕获试验 |
|---|---|---|---|---|---|---|
| 检出的分子 | 表面 | 细胞内和表面 | 分泌或细胞内 | 分泌(原位) | 分泌的 | 分泌(体内) |
| 多参数 | 是 | 是 | 是 | 否 | 否 | 否 |
| 单细胞/细胞亚群信息 | 是 | 是 | 否 | 频率,无子集信息 | 否 | 否 |
| 抗原特异性 | 是 | 是 | 是 | 是 | 是 | 是 |
| 试验后活力 | 是 | 否 | 是,对于分泌分子 | 否 | 是 | 是 |
| 蛋白质定量 | 可能相关* | 可能相关* | 是 | 否 | 是 | 是 |
| 仪器 | 流式细胞仪 | 流式细胞仪 | 流式细胞仪 | ELISPOT酶标仪 | 分光光度计 | 分光光度计 |
免疫表型:表面标记物和细胞内标记物的结合
使用多色流式细胞仪,由于可以同时将表面表型与细胞内细胞因子、转录因子或信号传导分子染色结合起来,则您可以根据T细胞的特征标记物鉴定单个的T细胞亚群。BD公司先进的试剂系统、广泛的标记物选择以及丰富的支持工具,可以帮助研究人员简化表型分析,并且可以最大限度地从单个样本中获得信息
通过流式细胞仪进行免疫表型,这是一种有价值的研究工具,利用细胞标记物的差异表达来分离和表征T细胞及其亚群。T细胞及其亚群,可以通过细胞表面标记物(比如CD3、CD4、CD8和CD25)的差异表达来确定。使用与这些特定标记物的直接偶联的荧光抗体检测panel,通过多色流式细胞仪分析,研究人员可以在单个细胞上同时分析多个标记物的水平。其可以提供关于特定样本中细胞谱系和细胞亚群分化状态方面的信息。添加诸如CCR7、CD62L或CD69这样的标记物到分析中,可以提供一些重要信息,比如身体内细胞归巢和定位的可能性,以及感兴趣的T细胞亚群的激活状态。通过分析各种标记物的表达模式,这不仅包括细胞表面受体,还包括分泌的细胞因子谱和细胞内信号传导分子,则研究人员已经确定了代表不同功能T细胞亚群(如Th1、Th2、Th17、Treg、Th9)的表型。
主要已知T细胞标志物
| 细胞类型 | 细胞毒性 | Th1 | Th2 | Th91 | Th17 | Tfh2 | Treg |
|---|---|---|---|---|---|---|---|
| 主要功能 | 杀死病毒感染的细胞 | 激活感染巨噬细胞的杀菌功能,并协助B细胞产生抗体 | 协助B细胞和转换抗体同种型生产 | T细胞增殖和B细胞产生的IgG和IgE增强 | 增强中性粒细胞重排 | 调控抗原特异性B细胞开发和抗体生产 | 免疫调控 |
| 靶向病原体 | 病毒和一些 | 细胞内病原体 | 寄生虫 | 寄生虫 | 真菌和细胞外细菌 | ||
| 有害功能 | 移植排斥 | 自身免疫性疾病 | 过敏性哮喘 | 过敏 | 器官特异性自身免疫性疾病 | 自身免疫性疾病 | 自身免疫性疾病,癌症 |
| 细胞外标记物 | CD8 | CD4, CXCR3 | CD4、CCR4、Crth2(人) | CD4 | CD4, CCR6 | CD4, CXCR5 | CD4, CD25 |
| 分化细胞因子 | IFN-γ, IL-2, IL-12, IL-18, IL-27 | IL-4, IL-2, IL-33 | IL-4, TGF-β | TGF-β, IL-6, IL-1, IL-21, IL-23 | IL-12, IL-6 | TGF-β, IL-12 | |
| 效应细胞因子 | IFN-γ, TNF, LT-α | IFN-γ, LT-α, TNF | IL-4, IL-5, IL-6, IL-13 | IL-9, IL-10 | IL-17A, IL-17F, IL-21, IL-22, IL-26, TNF, CCL20 | IL-21 | TGF-β, IL-10 |
| 转录因子 | T-bet, Stat1, Stat6 | GATA3, Stat5, Stat6 | GATA3, Smads, Stat6 | RORyet, RORα, Stat3 | Bci-6, MAF | FoxP3, Smad3, Stat5 |
标记物可因细胞环境、分化状态和其他因素而改变。以粗体显示的关键细胞因子BD Biosciences 为红色分子提供试剂。
- Soroosh P. Doherty TA.Th9和过敏性疾病免疫学 2009;127:450-458.
- Fozilleau N,Mark L. McHeyzer-Williams LJ,McHeyzer-Williams MG.滤泡辅助性T细胞:谱系和位置。免疫。 2009;30:324-335.
查看检测panel表,其详细展示了检测人体主要循环的多色流式细胞仪检测panel,从而检测CD4+ T细胞亚群。
通过细胞分选,分离选定的细胞群
通过使用表面标记物和细胞分选器的特定组合,如 BD FACSAria™ III, BD FACSMelody™ 和 BD FACSymphony™ S6 流式细胞仪系统,可以从复杂的细胞混合物中分离出确定的细胞群。纯化后的活细胞群,可以在培养中扩增、分化和保持。针对某些应用,BD生物科学公司的科学家门已经制定了详细的分选方案,例如利用富含CD4的细胞并对CD4 +CD25 int-CD127低表型进行分选从而分离人类Treg细胞的方法,其提供了更高的效率和产量
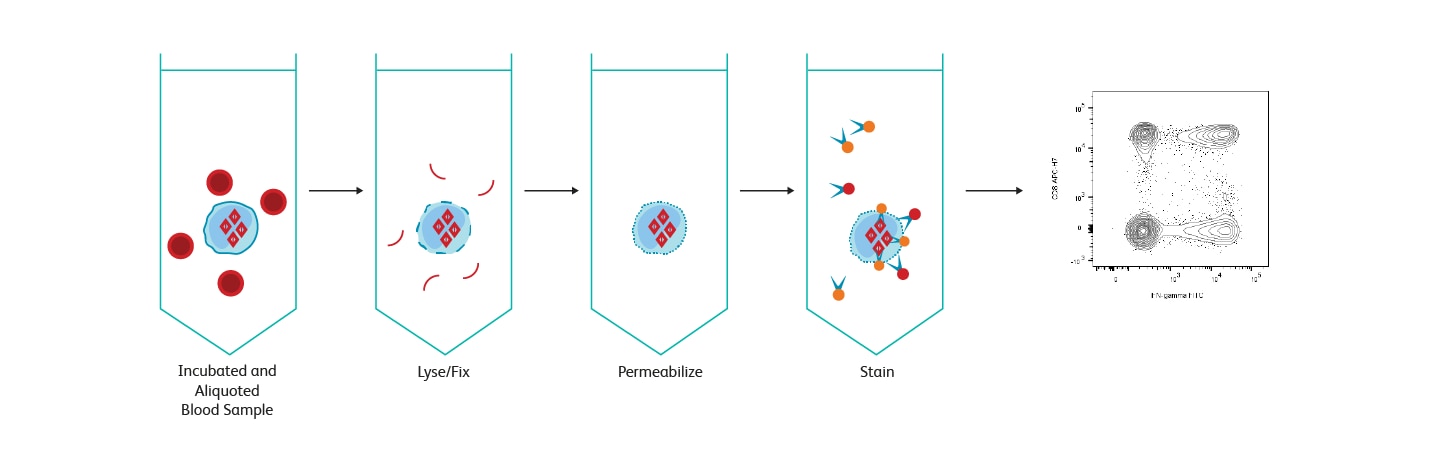
细胞内细胞因子检测,用于分析T细胞亚群特异性应答
使用多色流式细胞仪进行细胞内细胞因子的检测,是一项强大的工具,可以深入理解混合细胞群的应答图谱。由于该技术可以在一次测定中同时检测多个细胞因子和细胞表面标记物,则通过该技术,可以了解哪个细胞亚群产生了哪些细胞因子。例如,多色流式细胞仪可以根据Th1、Th2或Th17细胞的特征性细胞因子标记来鉴定它们。通过逐个细胞的分析,研究人员可以分析不同细胞亚群的应答,而不需要对它们进行物理化分开。
细胞内细胞因子检测系统
对于细胞内蛋白检测,需要细胞固定和破膜,从而使得荧光抗体进入并检测感兴趣的目标蛋白。由于不同的抗原对固定和破膜有不同的敏感性和要求,所以需要额外的优化方案。为了检测细胞因子(即分泌蛋白),蛋白质转运抑制剂需要捕获细胞内的蛋白质。BD生物科学公司提供了两种广泛使用的分析系统,用于细胞内细胞因子的检测:BD Cytofix/Cytoperm™试剂和BD FastImmune™细胞因子系统。这两种系统,均为研究人员使用测试试剂和方案,提供了便利和信心,并且两种系统均具备高质量标准并且可以重复使用,这是BD流式细胞仪产品闻名于世之处。BD Phosflow™试剂帮助您使用多色流式细胞仪来可靠地测量涉及T细胞信号传导的磷酸化蛋白水平,并且将数据与亚群鉴定相结合。
BD Cytofix/Cytoperm™试剂方法
BD Cytofix/Cytoperm™试剂方法和相关试剂,满足了基础研究中广泛存在的实验需求。由于产品的细胞因子和种类选择范围大,所以Cytofix/Cytoperm™试剂为细胞内细胞因子染色,提供了最大的灵活性。BD生物科学公司,提供了若干种通过细胞内流式细胞仪测量细胞内细胞因子的解决方案。
BD FastImmune™系统
BD FastImmune™系统旨在满足人类样本应用研究的需求。由于这种方法注重于系统的完整性,所以非常适合用于监测疾病期间的免疫状态或对候选疫苗的免疫应答方面的研究。BD FastImmune™CD4细胞内细胞因子检测试剂盒Anti-Hu-TNF-α/CD69/CD4/CD3旨在用于检测全血中抗原激活的CD4+ T淋巴细胞中的细胞内细胞因子和激活标记物CD69。其应用,包括研究T细胞对抗原(如疱疹病毒抗原、HIV抗原和肿瘤抗原)的应答。BD生物科学公司,提供了若干种通过细胞内流式细胞仪测量细胞内细胞因子的解决方案。 intracellular flow cytometry.
细胞内信号传导
BD Phosflow™试剂技术,提供了一种极其强大的方法来获取T细胞亚群特异性信号传导过程的动力学信息。
T细胞通过涉及若干种信号转导分子(包括抗原和细胞因子受体、激酶和转录因子)的复杂途径予以激活和调控。涉及蛋白磷酸化的信号,在初始 CD4+ T细胞分化为Th1、Th2、Th9、Th17、Tfh或Treg细胞中发挥作用。
检测瞬时磷酸化事件:BD Phosflow™试剂技术
创新的BD Phosflow™试剂技术,是第一个完整的流式细胞术解决方案,用于揭示细胞系和原代细胞的基础和诱导蛋白磷酸化事件的细胞内数据。BD Phosflow™试剂方法,对于研究这类T细胞(信号传导蛋白的磷酸化导致特定T细胞表型的表达),是特别有用的。
分泌细胞因子
为了检测样品中分泌细胞因子,BD提供多种检测方法。 BD® 流式微球测定 (CBA) 技术,可以同时定量分析多种可溶性细胞因子,而 BD OptEIA™ ELISA(酶联免疫吸附测定)试剂 设计用于定量分析单个细胞因子。BD® ELISPOT(酶联免疫斑点测定法)试剂,可以测定细胞因子产生细胞的频率,而BD® In Vivo Capture Assays 可以通过直接捕获体内细胞因子进行定量分析。
调节性T细胞监测
FoxP3染色
FoxP3(也被称为Scurfin、IPEX和JM2)是翼螺旋家族中的转录抑制因子。11已经发现采用FoxP3在具有调节活性的所有CD4+ Treg细胞中进行表达。FoxP3突变,与小鼠及人类对应的自身免疫性疾病IPEX(免疫失调、多内分泌腺病和肠病x连锁综合征)相关。
FoxP3用于确认分离的Treg的纯度和产量,或者用于表征固定的Treg细胞。然而,由于FoxP3染色对细胞有固定和破膜方面的要求,因此其不适合用于分离Treg活细胞。在这种情况下,CD25+CD127-表面标记是一个更好的解决方案。BD生物科学公司提供的人类FoxP3单克隆抗体克隆259D/C7,可与人类FoxP3转录因子目前已经鉴定的所有亚型发生反应,并且可以与猕猴、恒河猴和狒狒发生交叉反应。
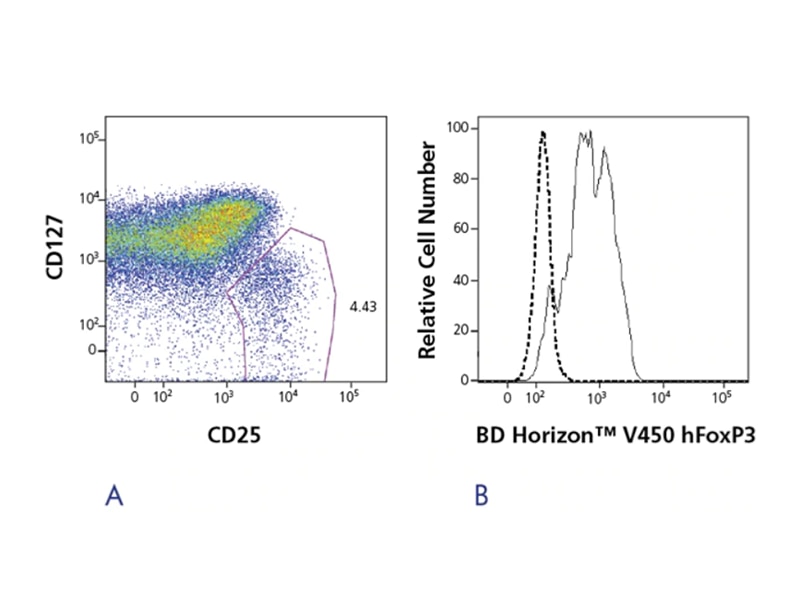
BD Pharmingen™人类FoxP3抗体,有多种型号和偶联剂可供选择,是一种检测FoxP3阳性Treg的试剂。这种简单易行的缓冲液体系,可以使研究人员只用几个简单的步骤就可以完成细胞固定和破膜,但是如果选用冻存样品的方法,则至少需要72小时。虽然FoxP3是一种经常用于Treg鉴定、分离和表征的标记物,但是,Treg依然是目前的一个研究热点,并且文献中已经发表了新型目标标记物的列表。为了支持这些新的发现,BD生物科学公司也在不断地研发出新的高质量试剂和溶液。
CD39:T-regs的增强表征
以前研究发现CD39主要位于B细胞、树突状细胞和某些T细胞亚型,最近的研究表明CD39与FoxP3共表达于人类和小鼠的CD4+ Tregs。15这一发现也被添加到关于Tregs不断增加的细胞表面标记物列表中,列表中有诸如CD25、CD45RA、HLA-DR和CTLA-4等表面标记物,这些表面标记物对于CD4+ Tregs的鉴定和功能表征是至关重要的。
细胞外ATP(三磷酸腺苷)和它的代谢产物,是有效的调节分子,可以调节大部分细胞和器官的功能。细胞ATP(三磷酸腺苷)释放是组织破坏的标记和激活免疫应答的一种危险信号。CD39将细胞外ATP(或者其他三磷酸苷)水解成相应的核苷酸,比如AMP(一磷酸腺苷)。而反过来,细胞外的单磷酸核苷被可溶性或膜结合性的胞外5'-核苷酶(CD73)迅速降解为核苷(如腺苷)。然后,细胞外周的腺苷介导抗炎症性的T细胞应答。CD39和CD73的共表达,被认为是Tregs介导的免疫抑制的关键机制之一。16
BD Pharmingen™的抗人CD39(克隆TÜ66)单克隆抗体,是人类Tregs的一种标记物,并且可以作为流式细胞仪即用型试剂盒的PE及APC级联试剂。TÜ66能够识别ENTPD1,ENTPD1是一种胞外酶,属于胞外核苷三磷酸二磷酸水解酶类家族(E-NTPDases)。该家族的成员参与胞外核苷酸分解代谢,控制胞外核苷三磷酸(NTPs)的数量。
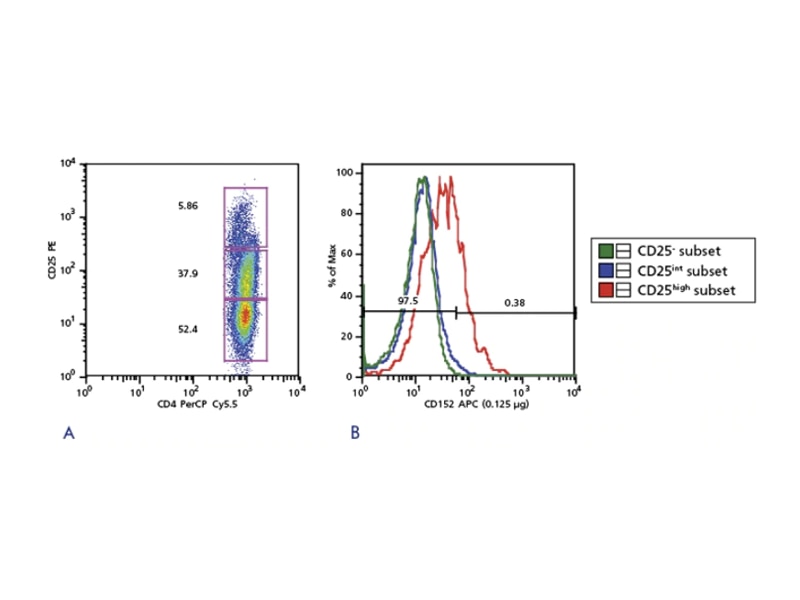
CD152:CTLA4
细胞毒性T淋巴细胞抗原4(CTLA-4或CD152)对于Treg的抑制功能,是至关重要的。阻断CD152,也会减弱Tregs的抑制活性。据报道,CD152异常表达在类风湿性关节炎等自身免疫性疾病中也有一定作用。15已知的细胞群(Treg细胞类型)、现有标记物以及新兴的标记物,将极大地促进Treg生物学研究的新发现。
Treg富集
Tregs代表一个小的细胞群;为了下游分析,富集往往是必要的。已经有几种富集全部Tregs或其亚群的方法。虽然FoxP3是目前公认的Tregs最特异的标记物,但是因其位于细胞内而限制了它在分离活的Tregs中的应用。其他用于富集的标记物,有阴性选择的、阳性选择的或联合使用的。一种已报道的阴性选择方法,是除去表达CD127和CD49d的细胞。阳性选择,是收集表达CD4阳性和CD25强阳性的细胞。联合的方法,可以包括在细胞分选之前使用磁珠除去非目的细胞群。一个最好的富集方法,是收集CD4+、CD25+和 CD127-细胞。
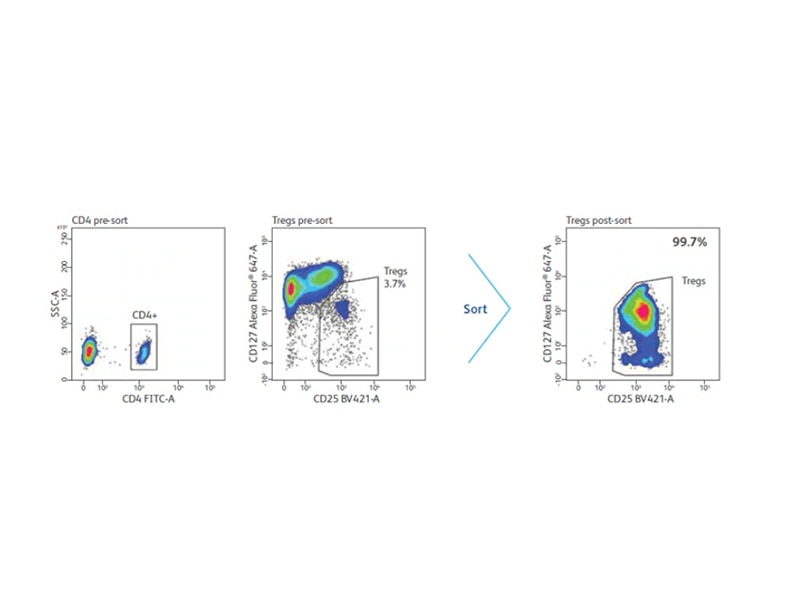
采用CD4和CD25富集Tregs
在人类中,最初的Treg细胞群的分析表明,只有体外高水平表达的CD25(约占CD4 T细胞总数的2-3%)的细胞在体外才有抑制功能,而这是相对于把高表达CD25的细胞都当做Tregs的小鼠细胞而言。而且,认为表达为低到中等水平CD25的细胞,在体外没有任何抑制活性。
另外,CD25表达的高水平和低水平,缺乏统一的标准,并且用流式细胞仪分选人的活Tregs时有一定的局限性。结果,许多研究人员仅选择了具有CD25高表达的细胞,这明显地降低了Tregs的分选产量。这些结果迫使要想得到高产量的人类Tregs,必须寻找除了CD4和CD25之外的其他细胞表面标记物。18
磁选预富集CD4+ T细胞,以增加Tregs的产量
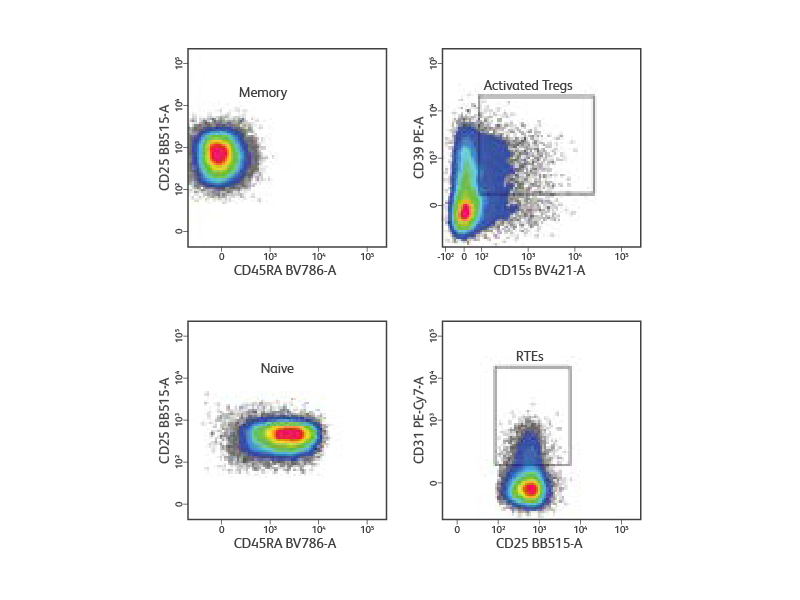
从健康供者中分离外周血单个核细胞,采用表面标记物(CD3、CD4、CD25、CD127和CD45RA)混合物染色,用于Treg亚群的检测和纯化。首先根据光散射特性门控淋巴细胞和单线,然后门控CD3+CD4+T细胞(未显示)。然后将Tregs鉴定为CD127low/neg CD25high。从Treg门控识别CD45RA+初始和CD45RA-记忆Tregs,并在纯度模式下以5,000事细胞/秒进行分类。分类后分析显示记忆和初始treg的同质群体。然后对纯化细胞进行染色,以获得用于免疫表型分析的其他表面标记物(CD31、cd39和CD15)。在CD45RA+初始Tregs中检测到CD31+近期胸腺移出物(RTE),而在CD45RA-记忆Tregs中检测到高度活化的Tregs
参考
- Di Caro V, D'Anneo A, Phillips B, et al. Interleukin-7 matures suppressive CD127(+) forkhead box P3 (FoxP3)(+) T cells into CD127(-) CD25(high) FoxP3(+) regulatory T cells. Clin Exp Immunol. 2011;165(1):60-76. doi:10.1111/j.1365-2249.2011.04334.x
- Tøndell A, Wahl SGF, Sponaas AM, Sørhaug S, Børset M, Haug M. Ectonucleotidase CD39 and checkpoint signalling receptor programmed death 1 are highly elevated in intratumoral immune cells in non-small-cell lung cancer. Transl Oncol. 2020;13(1):17-24. doi:10.1016/j.tranon.2019.09.003
- de Oliveira Bravo M, Carvalho JL, Saldanha-Araujo F. Adenosine production: a common path for mesenchymal stem-cell and regulatory T-cell-mediated immunosuppression. Purinergic Signal. 2016;12(4):595-609. doi:10.1007/s11302-016-9529-0
- Attias M, Al-Aubodah T, Piccirillo CA. Mechanisms of human FoxP3+ Treg cell development and function in health and disease. Clin Exp Immunol. 2019;197(1):36-51. doi:10.1111/cei.13290
-
应用说明
-
手册
-
常问问题
-
产品信息表
-
方案
-
网络研讨会
仅供研究使用,不用于诊疗程序。
Cy是全球生命科学解决方案德国股份有限公司的商标,或者以Cytiva名义开展业务的附属公司。