-
Reagents
- Flow Cytometry Reagents
-
蛋白质印迹试剂
- 免疫分析 试剂
-
Single-Cell Multiomics Reagents
- BD® AbSeq Assay
- BD Rhapsody™ 附件试剂盒
- BD® Single-Cell Multiplexing Kit
- BD Rhapsody™ TCR/BCR Next Multiomic Assays
- BD Rhapsody™ Targeted mRNA Kits
- BD Rhapsody™ Whole Transcriptome Analysis (WTA) Amplification Kit
- BD® OMICS-Guard Sample Preservation Buffer
- BD Rhapsody™ ATAC-Seq Assays
- BD® OMICS-One Protein Panels
- BD OMICS-One™ WTA Next Assay
-
Functional Assays
-
显微成像试剂
-
Cell Preparation and Separation Reagents
Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

单细胞多组学
The ability to analyze the expression of genes and proteins at the single-cell level via single-cell multiomics has now enabled deeper insights about cell behavior and function. Single-cell multiomics is now providing users the ability to analyze transcripts and proteins simultaneously across thousands of cells at the single-cell level in the same workflow. BD Biosciences’ multiomic tool, the BD Rhapsody™ Platform and its associated reagents, are all designed to facilitate and support your single-cell multiomic research.
BD Biosciences tools for single-cell multiomic analyses
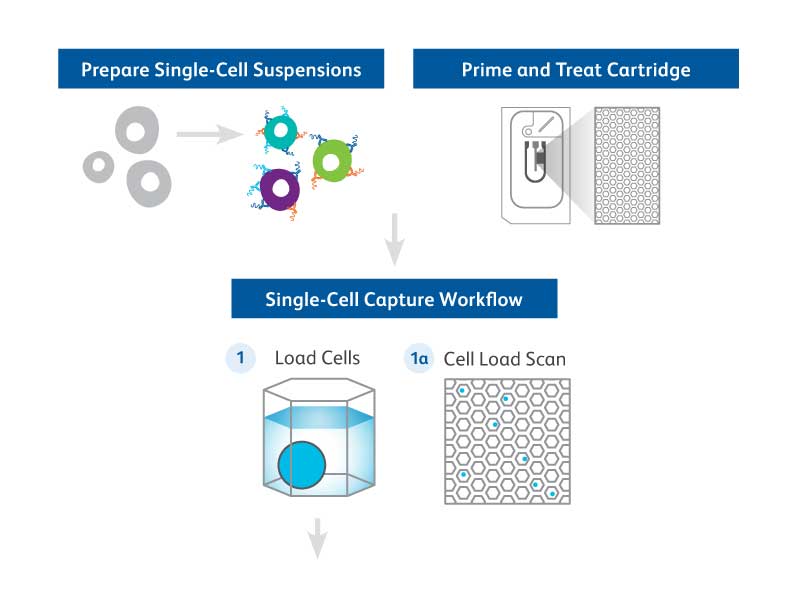
BD Rhapsody™单细胞分析系统能够进行高通量的单细胞多组学分析,其中包括一个配有质量监测功能的微孔仪器平台,一个RNA和蛋白质分析阵列,如BD Rhapsody™全转录组分析、BD Rhapsody™靶向mRNA流式方案和BD Rhapsody™TCR/BCR分析系统,BD®AbSeq Antibody-Oligo以及软件工具。BD Rhapsody™ System可以与其他上游BD细胞富集技术(如荧光激活细胞分选)无缝结合,使用户能够深入研究自己感兴趣的细胞。单细胞多组学技术的应用涵盖了广泛的研究领域,不仅有免疫学和免疫肿瘤学的研究,也有关于代谢疾病分子基础的理解。BD Rhapsody™平台为研究人员应用多组学工具深入各自的研究领域铺平了道路。下面的章节突出显示了BD Rhapsody™平台生成的选定关键应用数据。
免疫肿瘤学研究
慢性淋巴细胞白血病表型
慢性淋巴细胞性白血病(CLL)是成人中最常见的一种白血病,其特征为血液和骨髓中功能不健全淋巴细胞的累加。最近的大量RNA测序研究表明,CLL样本中存在异质性,这就证实了单细胞RNA测序对于表征潜在转录谱的必要性。下面的例子说明了如何使用BD Rhapsody™单细胞分析系统同时分析临床CLL样本中单个细胞内的基因和蛋白表达。
实验大纲
用BD®单细胞多路试剂盒试剂、荧光铬标记抗体和33个BD®AbSeq标记物同时对3名健康供者和4份CLL样本中的外周血单核细胞(PBMC)进行染色。然后,使用BD FACSMelody™细胞分选仪对不同样本中的CD19+细胞进行分类,并在装载到BD Rhapsody™系统之前将其合并到一起。测序前,采用靶向BD Rhapsody™免疫反应流式方案(399个基因)合成并处理cDNA以完成库制备。使用BD Rhapsody™Analysis Pipeline和SeqGeq™v1.6软件对数据进行分析。
BD Fluorochrome-Labeled Antibodies Used for Sorting
| Marker | Fluorochrome |
|---|---|
| CD3 | APC |
| CD14 | APC |
| CD16 | APC |
| CD19 | PE |
| CD41a | APC |
| CD56 | APC |
| CD235a | APC |
List of fluorochrome-conjugated antibodies (above) and BD® AbSeq Antibodies (right) used in this study.
| AbSeq Marker | |||
|---|---|---|---|
| CD4 | CD24 | CD80 | CD184 |
| CD5 | CD27 | CD81 | CD275 |
| CD7 | CD33 | CD86 | CD279 |
| CD8 | CD34 | CD90 | CD294 |
| CD9 | CD38 | CD103 | IgG |
| CD10 | CD40 | CD117 | IgD |
| CD11c | CD45 | CD123 | |
| CD19 | CD45RA | CD127 | |
| CD20 | CD69 | CD133 | |
| BD Fluorochrome-labeled Antibodies Used for Sorting |
|---|
| Marker | Fluorochrome |
|---|---|
| CD3 | APC |
| CD14 | APC |
| CD16 | APC |
| CD19 | PE |
| CD41a | APC |
| CD56 | APC |
| CD235a | APC |
| BD Fluorochrome-labeled Antibodies Used for Sorting | |||
|---|---|---|---|
| AbSeq Marker | |||
| CD4 | CD24 | CD80 | CD184 |
| CD5 | CD27 | CD81 | CD275 |
| CD7 | CD33 | CD86 | CD279 |
| CD8 | CD34 | CD90 | CD294 |
| CD9 | CD38 | CD103 | IgG |
| CD10 | CD40 | CD117 | IgD |
| CD11c | CD45 | CD123 | |
| CD19 | CD45RA | CD127 | |
| CD20 | CD69 | CD133 | |
本研究使用的荧光染料标记抗体(左)和BD®AbSeq抗体(右)列表。
健康与疾病样本的多组分析。
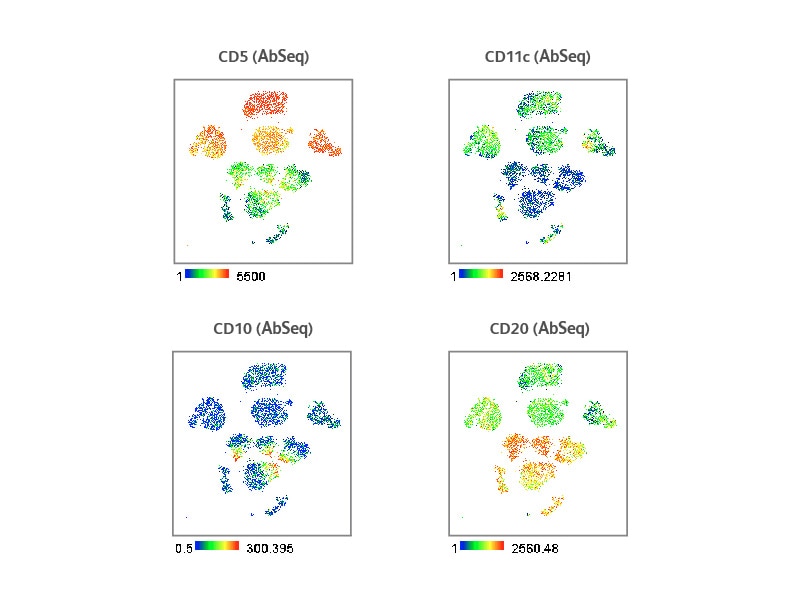
为了分析上述工作流程产生的数据,使用mRNA表达、表面蛋白表达或两者对4份CLL样本和3份健康供者样本进行了t-SNE分析。基于AbSeq数据生成的t-SNE图表明,与单独使用RNA-Seq数据相比,不同样本之间的分离度更高。mRNA和AbSeq数据的结合大大提高了不同样本的分辨率。如t-SNE图所示,四份CLL样本单独形成了不同的集群,而健康样本则有较大程度的重叠,这表明CLL患者的临床病程可能是异质性的。这些结果也凸显了多组学在分析单细胞图谱方面的作用。

经AbSeq分析确定的关键蛋白标记物的差异。
CLL的特点为CD5+B淋巴细胞的克隆扩增和集聚。此外,CLL患者的恶性B细胞也可以表达更高水平的CD11c。BD®AbSeq Reagent显示,与健康供者样本相比,CLL样本中的CD11c和CD5表达更高,这与CLL的发病机制相关。另一方面,与健康供者样本相比,CLL样本中CD10和CD20表达较低,这与已发表的文献中的结果一致。
健康供者样本和CLL样本间差异表达标志物的分析。
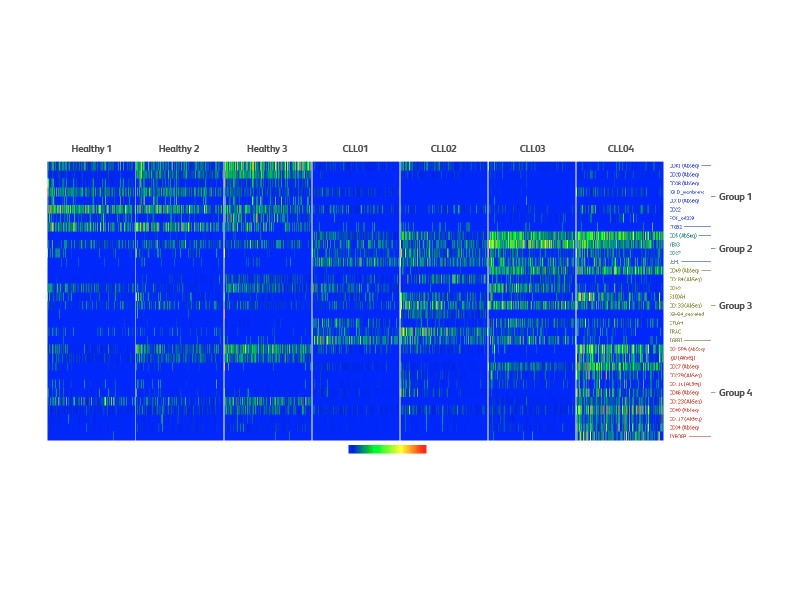
为了了解健康供者样本和CLL样本之间不同聚类的标记物,使用单细胞mRNA和AbSeq数据进行了差异表达分析。该分析确定了与健康供者样本相比CLL样本减少的标记物(第1组)。所有CLL样本中差异化增加的基因或蛋白质均列于在第2组(所有CLL),而一些CLL样本中增加的基因或蛋白质列于第3组。CLL患者中异常表达的标记物CD5在CLL03和CLL04中的表达水平高于其他样本。此外,还发现了一个与CLL04特异性相关的标记物子集(第4组),如CD11c。有趣的是,并非所有细胞都能分泌相同水平的CD11c,这就表明了CLL的肿瘤内异质性。
总结
本研究采用约500个靶基因和33个BD®AbSeq抗体重点探究了3份健康供者样本和4个份CLL样本之间的差异。结合mRNA和AbSeq数据,将CLL和健康供者样本聚集成不同的组。本研究确定了CLL样本与健康对照样本中差异化表达的独特标记物。在CLL样本中观察到了显著的异质性,特别是在CLL04样本中。总体而言,对CLL样本的单细胞多组学研究揭示了对它们独特分子特征的新见解。对于CLL这种癌症而言,这种见解可能有助于设计更好的治疗方法。更多详细信息,请下载详细说明上述研究的CLL异质性数据表。
免疫学研究- T细胞生物学
几十年来,BD一直致力于开发推动免疫学研究的前沿工具。我们也继续支持免疫学家在单细胞多组学领域的研究。请阅读下文,了解如何使用BD Rhapsody™单细胞分析系统来解决免疫学研究的关键问题。
T细胞衰竭研究
衰竭T细胞的更深层特征
目前,了解T细胞等细胞类型的活化和衰竭的基础已成为免疫疗法发展的基础。这对于一些快速发展的免疫治疗领域更为关键,如CAR-T疗法。扩增改造的T细胞事临床生产CAR-T细胞的关键步骤。为了获得治疗产品所需的足够细胞,必须对细胞进行长期刺激,这不仅会增加T细胞衰竭的风险,而且会降低治疗效果。因为目前正在开发优化CAR-T细胞产量、功能和持久性的T细胞扩张实验方案,所以了解体外操作对T细胞特性的影响的基本问题是很重要的。记住这一点,下文所述的研究说明了如何通过使用常规T细胞活化模型进行单细胞多组分析来解决这些潜在的基本问题。
实验设计
在存在IL-2和CD3/CD28 Dynabeads™磁珠的情况下,刺激提取自外周血单核细胞的磁富集T细胞,为期3天。慢性刺激又持续了11天。通过移除Dynabeads™ 磁珠,在存在IL-2的情况下进行另外11天的细胞培养,进行短时刺激。共采集和冷冻了5个样品(新鲜T细胞),对细胞刺激3天、7天和14天(慢性刺激),或者对细胞刺激3天、休息11天(短时刺激)。
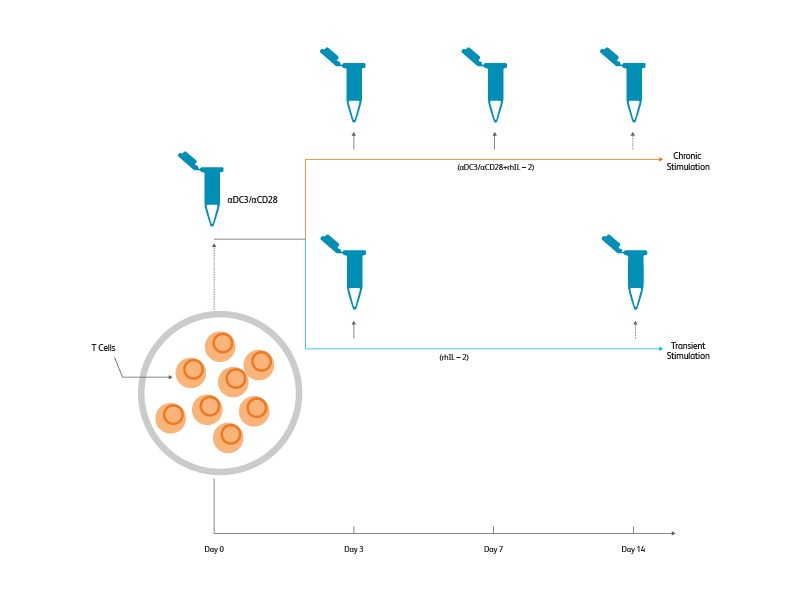
从每个时间点生成两份测试样品。将每个样品的一份测试样解冻,并用39个BD® AbSeq抗体和BD®单细胞复合抗体进行染色。将样品汇集和装入两个BD Rhapsody™ 试剂盒中(约3,000个细胞/样品)。采用BD Rhapsody™ T细胞靶向流式方案来评估这些样品中的mRNA表达水平。用12色流式细胞术组合方案对第二份冰冻细胞测试样进行染色,并在BD LSRFortessa™ X-20细胞分析仪上进行分析。
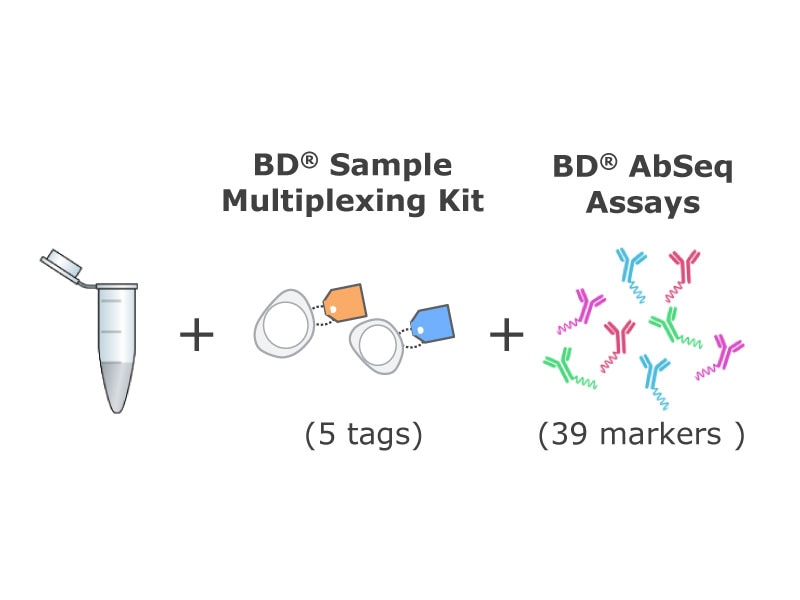
BD®AbSeq抗体和流动抗体本研究中使用
BD®AbSeq流式方案发现39种蛋白质在T细胞活化、抑制/衰竭、分化或趋化性中发挥着作用。同时,设计了一个配套12色流式细胞术组合方案,该方案具有所选择的重叠特异性,以便评估流式细胞术与AbSeq技术之间的一致性。scRNA-Seq流式方案包括400个与免疫反应相关的基因。这里所示的所有数据均来自CD8+T细胞。
| 39-Plex AbSeq Panel | |||
|---|---|---|---|
| CD4 | CD278 (ICOS) | CD103 | CD94 |
| CD8 | CD178 (FAS-L) | CD30 | CD95 |
| CD279 (PD-1) | CD183 (CXCR3) | CD38 | CD98 |
| CD223 (LAG-3) | CD185 (CXCR5) | CD39 | CD2 |
| CD366 (TIM-3) | CD194 (CCR4) | CD44 | TCRab |
| CD272 (BTLA) | CD196 (CCR6) | CD45RA | CD154 |
| CD357 (GITR)/td> | CD137 (4-1BB) | CD49a | CD7 |
| CD226 (DNAM-1) | CD134 (OX40) | CD54 | CD2 |
| CD152 (CTLA-4) | CD27 | CD62L | CD25 |
| CD270 (HVEM) | CD28 | CD69 | |
| 12-color Flow Cytometry Panel | ||
|---|---|---|
| Marker | Fluorochrome | |
| CD4 | BUV805 | |
| CD8 | BUV395 | |
| CD279 (PD-1) | PE-Cy7 | |
| CD152 (CTLA-4) | PE | |
| CD223 (LAG-3) | BV480 | |
| CD366 (TIM-3) | BV711 | |
| CD39 | BUV737 | |
| CD103 | APC | |
| CD45RA | APC-H7 | |
| CD62L | FITC | |
| CD95 | BV786 | |
| CD357 (GITR) | BV421 | |
用于本研究的BD®AbSeq抗体(左)和荧光染料标记抗体(右)列表。
T细胞分析
对每个样品,可以分辨出不同的细胞簇,并且对于仅基于蛋白质的细胞簇,仅基于mRNA的细胞簇,或结合这两者的细胞簇,其分辨率是相当的。短时刺激的细胞簇(第14天)与新鲜T细胞和慢性刺激的细胞会分别出现,这说明与先前的观察相比存在明显的特征这说明与先前的观察相比存在明显的特征,表明它们在表型和功能上与新鲜细胞相似。慢性刺激细胞(第3天、第7天和第14天)形成的簇与新鲜细胞簇相互分开。这三个样品形成了不同的簇,这说明它们各自具有独特的特征。
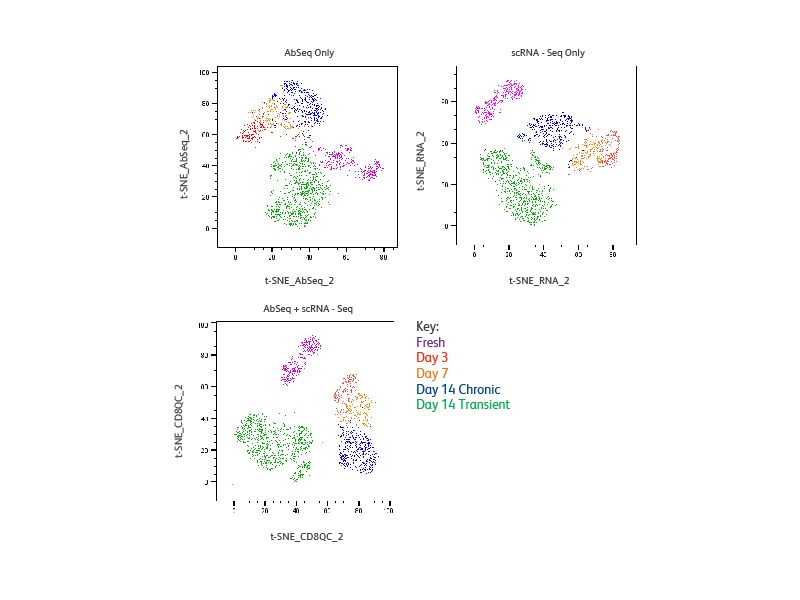
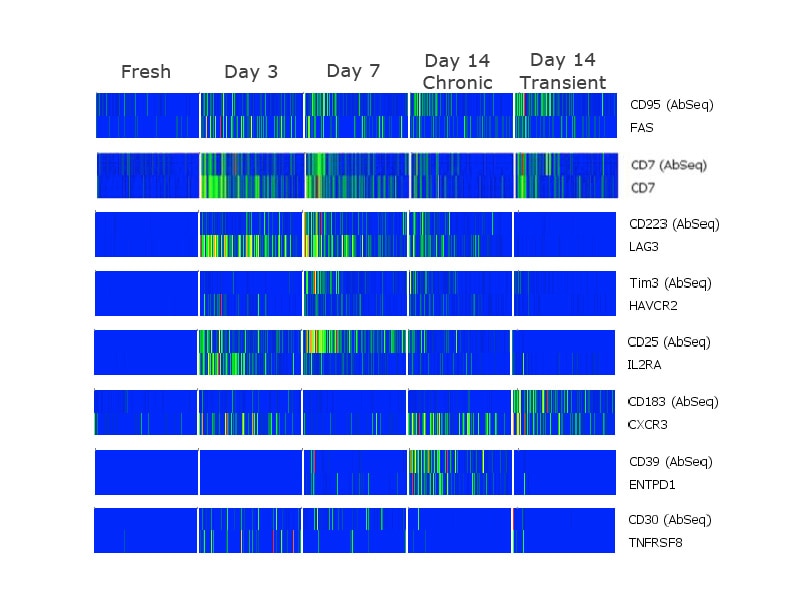
在单细胞水平,分析蛋白质与基因表达的相关性。
分析不同群体的蛋白质和mRNA特征,就可以得出若干见解。其中,一些包括像CD7这样的标记,其中,在不同的时间点,蛋白质和mRNA的表达表现出很强的相关性。激活第3天时,CD103(ITGAE)mRNA上升,而蛋白表达在激活第7天后才上升。在慢性刺激的细胞中,CD38 mRNA在第3天时上升,并随时间的过去而不断增大,而蛋白表达在第14天时上升。在短时刺激的细胞中,尽管mRNA表达未能保持,但是在第14天时出现CD38蛋白。
BD®AbSeq标记物数据与流式细胞术的一致性
流式细胞术和AbSeq检测的CD8T细胞表达标记百分比和细胞表面标记水平均表明,蛋白质表达的动力性能是一致的。这些数据有力地证明了这两种技术在研究蛋白质表达方面的一致性和实用性。
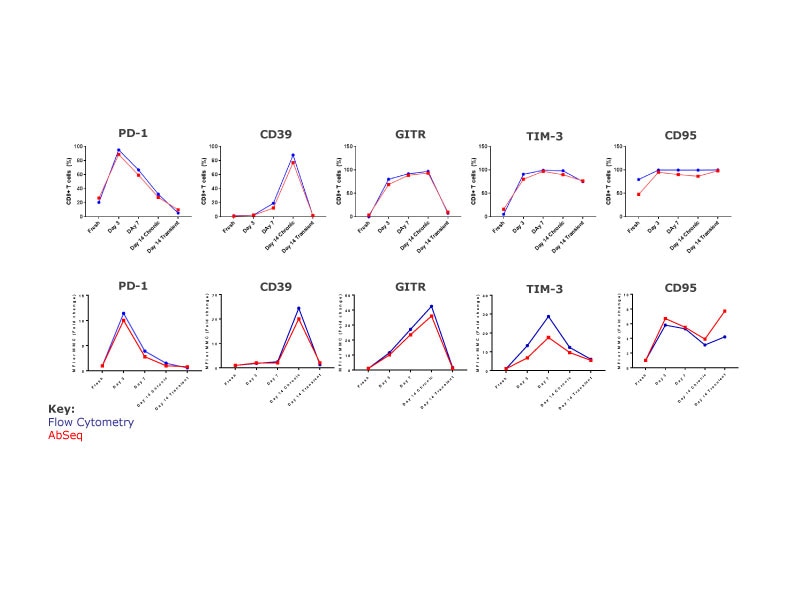
总结
使用AbSeq可以在简化的工作流程中对大量蛋白质(本研究中为39种)进行广泛分析。AbSeq技术能够分辨不同种类的抗原(一级、二级、三级),在不同频率(从稀有到丰富)时,这些抗原可以在细胞亚群上以不同密度(从低到高)表达。另外,采用BD Rhapsody™ 系统试剂,本研究检测了在不同刺激条件下随时间变化的基因和蛋白质的表达。蛋白质和mRNA表达的同时分析有助于评估mRNA和蛋白质表达的相关性,以确定潜在调控机制,从而获得更精细和更深入的细胞特征。有关更多详细信息,请下载详细说明上述研究的T细胞衰竭数据表。
调节性T细胞研究
通过单细胞多组学分析对调节性T细胞进行综合表征
调节性T细胞(Tregs)在维持机体免疫平衡中起着重要作用,其改变可能与肿瘤恶化或自身免疫性疾病的发生有关。调节性T细胞并不是功能均一的细胞群体,根据CD45RA和HLA-DR的表达,可以将其分类为原始调节性T细胞亚组或活化调节性T细胞亚组。本研究采用BD Rhapsody™人类免疫反应流式方案和BD® AbSeq抗体,进一步详细分析调节性T细胞亚群,并确定公认的细胞分化轨迹。在单细胞水平上分析了22种蛋白质,包括刺激/抑制受体和细胞因子/趋化因子受体以及399mRNA转录物。
实验设计
采用细胞分选的荧光染料标记抗体和下游测序基蛋白质检测的BD®AbSeq抗体,对健康捐献者的外周血单核细胞(PBMC)进行共同染色。对样品进行CD4+CD25+CD127低/ - 调节性T细胞分选,并将5,000个分选调节性T细胞加载到BD Rhapsody上™单细胞分析系统上,以便进行单细胞捕获。检索样品发现,已建立BD®AbSeq和mRNA(BD Rhapsody™ 人类免疫反应流式方案)库,可用于测序。采用BD Rhapsody™ 分析流程和SeqGeq™ 软件,对测序结果进行了分析。
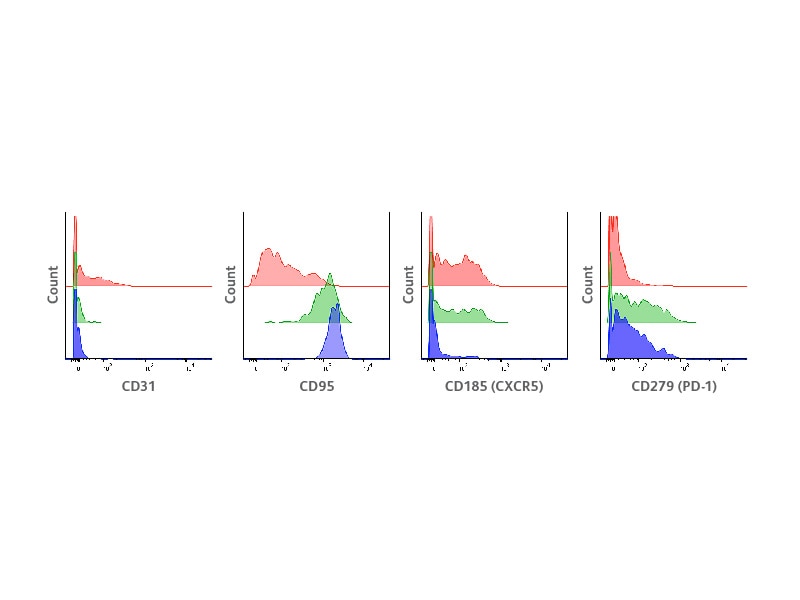
采用BD®AbSeq抗体对调节性T细胞进行表型特征研究
本研究中,首先评估BD®AbSeq抗体明确识别先前使用其它技术定义的主要调节性T细胞亚群的能力。结果表明,BD®AbSeq抗体能够清晰地分辨出连续表达的抗原,如CD45RA和HLA-DR,它们分别确定了原始调节性T细胞和活化调节性T细胞。在CD45RA+HLA-DR−原始细胞、CD45RA−HLA-DR+活化细胞和CD45RA−HLA-DR−细胞内,测量出所选标记物的表达。与先前报道一样,仅在一小部分CD45RA+HLA-DR-原始调节性T细胞中检测到了CD31,这代表胸腺新迁出细胞(RTEs)。另一方面,CD95在CD45RA−HLA-DR−和CD45RA−HLA-DR+活化群体中均有表达,这与在活化调节性T细胞中发现CD95+凋亡敏感细胞的先前报道保持一致。同时,发现趋化因子受体CD185(CXCR5)和抑制性受体CD279(PD-1)也具有不同的表达模式。
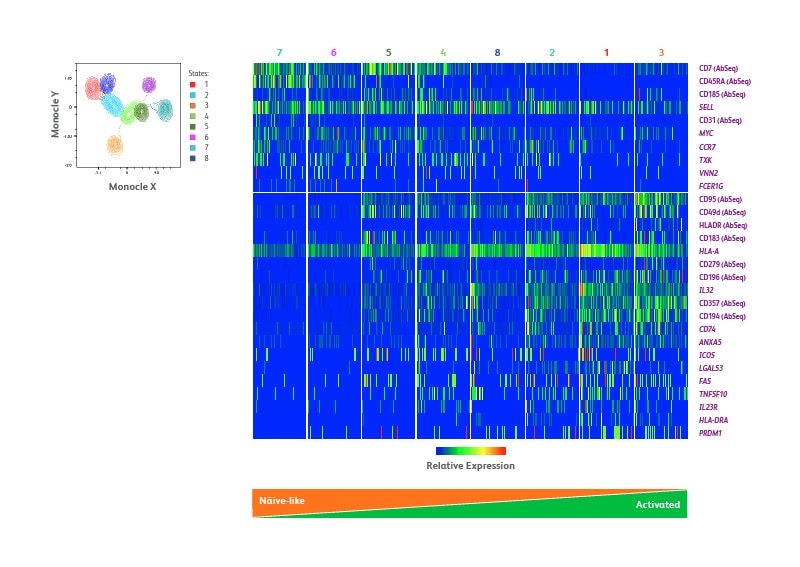
通过单核细胞分析对调节性T细胞分化进行表型特征研究
采用无监督的高维数据分析,改进对调节性T细胞亚群的识别。采用Monocle算法进行单细胞轨迹分析,并确定细胞分化过程的过渡状态。根据22个蛋白和399个mRNA靶点的表达,共发现了8种不同的状态,这可能代表了调节性T细胞的不同分化状态。下图(B)中的单细胞热图显示了在八种状态下具有差异表达的选定蛋白质和基因。根据CD45RA的逐渐丧失和HLA-DR的上调,将每种状态的细胞从左到右排列,以代表从原始细胞到活化细胞的发展。除CD45RA表达水平的差异外,还可以进一步区分这三种状态,因为CD31只在状态7细胞中表达,这与RTE的特征一致。另一方面,状态5下CD95的单独表达和CD45RA的同时下调,表示从原始细胞向凋亡敏感和活化细胞的转变。
总结
本研究证明了BD Rhapsody™平台及其多组学分析工具(例如BD®AbSeq抗体)的灵敏度和特异性,从而根据已知表面标记特征识别调节性T细胞亚群。单细胞多组学分析和高维数据分析的结合,进一步使得能够清晰分辨由独特蛋白质和基因表达特征定义的不同调节性T细胞亚群,这可能代表调节性T细胞的独特分化状态。
有关更多详细信息,请下载详细说明上述研究的调节性T细胞数据表。
免疫学研究 - 固有免疫系统
固有淋巴细胞(ILC)
采用单细胞多组学分析,解决人类循环固有淋巴细胞的异质性
固有淋巴细胞(ILC)是新近发现的一个不表达重组抗原受体的淋巴细胞家族,在炎症、感染、癌症、代谢紊乱和过敏等疾病中承担着重要作用。它们代表了一个异质群体,包括传统定义的自然杀伤(NK)细胞以及最近所述的非细胞毒性固有淋巴细胞。根据细胞因子产生和转录因子表达的不同模式,在粘膜组织和非粘膜组织中,已确定了三个主要的非细胞毒性固有淋巴细胞分组。但是,采用单细胞RNA测序(scRNA-Seq)或高参数大量细胞计数法的最新论文表明,固有淋巴细胞存在不仅仅三个固有淋巴细胞分组;因此,需要更好地认识固有淋巴细胞的异质性,以确定其在疾病发病机制中的作用,并确定固有淋巴细胞的靶向性是否有助于预防或治疗这些疾病。通过整合同一细胞的表型和转录数据,单细胞多组学技术的出现提供了进一步解决固有淋巴细胞的异质性的机会。
实验大纲
采用HetaSep™(STEMCELL Technologies)分离外周血白细胞,并采用一组12个荧光染料标记抗体进行标记,以便进行细胞分选。同时,采用42个寡核苷酸结合的BD®AbSeq抗体对这些细胞进行染色,以便通过二代测序来检测下游蛋白。将BD Horizon Brilliant Violet™ 510(BV510)染料标记的CD19、CD14、TCRγδ、TCRαβ、CD123、CD1a、BDCA2和FCεR1α抗体混合剂作为排除谱系细胞的“转储通道”。为了确保清晰分辨和排除T细胞和NK细胞,将CD3和CD56抗体添加到分选流式方案中。将总固有淋巴细胞定义为谱系CD45+CD127+细胞,采用BD FACSAria融合细胞分选仪™对其进行分选,并加载到BD Rhapsody™ 单细胞分析系统上,以便进行单细胞捕获。检索样品发现,已建立单细胞BD®AbSeq和mRNA(BD Rhapsody™ 人类免疫反应流式方案)库,可用于测序。采用BD Rhapsody™ 分析流程和SeqGeq™ 软件,对数据进行了分析。然后,将采用单细胞分析发现的生物信息,用于指导高参数流式细胞术组合方案的设计。在BD FACSymphony™ A5细胞分析仪上,使用21色流式细胞术组合方案对4例健康捐献者的外周血固有淋巴细胞进行分析,从而验证从多组学分析得到的信息。
| Marker | Clone | Fluorochrome |
|---|---|---|
CD19 CD14 TCR TCR CD1a CD123 BDCA2 FC | SJ25-C1 M 11F2 IP26 HI149 9F5 V24-785 AER-37 | BV510 |
| CD45 | 2D1 | FITC |
| CD3 | SK7 | APC-H7 |
| CD56 | B159 | PE-C |
| CD127 | HIL-7R-M21 | BV421 |
| BD® AbSeq Panel | |||
|---|---|---|---|
| Marker | Clone | Marker | Clone |
| CD2 | RPA-2.10 | CD90 | 5E10 |
| CD3 | SK7 | CD94 | HP-3D9 |
| CD4 | SK3 | CD98 | UM7F8 |
| CD5 | UCHT2 | CD103 | BER-ACT8 |
| CD7 | M-T701 | CD117 | YB5.B8 |
| CD8 | RPA-T8 | CD125 (CTLA-4) | BNI3 |
| CD11b | M1/70 | CD161 | DX12 |
| CD11c | B-LY6 | CD183 (CXCR3) | 1C6/CXCR3 |
| CD14 | MϕP9 | CD184 (CXCR4) | 12G5 |
| CD16 | 3G8 | CD196 (CCR6) | 1149 |
| CD19 | SJ25C1 | CD223 (LAG-3) | T47-530 |
| CD25 | 2A3 | CD226 (DNAM-1) | DX11 |
| CD27 | M-T271 | CD274 (PD-L1) | MIHI |
| CD28 | CD28.2 | CD275 (B7-H2 | 2D3/B7 |
| CD34 | 581 | CD278 (ICOS) | DX29 |
| CD45RA | HI100 | CD279 (PD-1) | EH12.1 |
| CD49a | SR84 | CD294 (CRTH2) | BM16 |
| CD49d | 9F10 | CD314 (NKG2D) | 1D11 |
| CD56 | NCAM16.2 | CD335 (NKp46) | 9E2/NKP46 |
| CD62L | DREG-56 | CD336 (NKp44) | p44-8 |
| CD69 | FN50 | CD366 (TIM-3) | 7D3 |
多组学分析揭示的主要固有淋巴细胞亚群差异
通过对三个主要循环固有淋巴细胞组【通常定义为CD117−CD294−ILC1、CD117+/−CD294+ILC2和CD117+CD294−ILC祖细胞/ILC3(ILCP/ILC3)】的手动设门,进行最初数据分析。采用单细胞AbSeq和mRNA数据,在三个固有淋巴细胞组之间进行差异表达分析,并确定每个组的独特蛋白质和mRNA特征。该分析还揭示了定义固有淋巴细胞组的关键转录因子的预期表达模式。例如,编码T-bet(TBX21)的基因仅在ILC1细胞的一个亚群中有表达,而GATA3在ILC2细胞中表达水平最高。正如最近报道的所述,RORC(编码RORγδ)部分由显示ILC3表型的循环固有淋巴细胞的祖细胞(CD117+CD294−ILCP/ILC3细胞)表达。

关于ILC1群体异质性的见解
单细胞热图也显示了每个固有淋巴细胞组内的异质性,因为大多数代表性标记并不是由所有细胞均匀表达的。因此,这些数据表明,在每个固有淋巴细胞组内都存在额外的亚群。例如,CD4仅由大多数(但不是全部)ILC1细胞表达。该观察结果与以前的报道一致,并通过双变量图分析得到进一步证实,所述双变量图分析清楚地显示了ILC1中CD4+和CD8+细胞的离散亚群,而不是ILC2或ILCP/ILC3细胞。

ILC1异质性的单细胞多组学分析
为了进一步研究ILC1细胞的异质性,在CD4+CD8−、CD4−CD8+和CD4−CD8− ILC1三个亚群之间进行了差异基因和蛋白质表达分析。图B(上图)显示了与每个亚群相关的代表性蛋白质和基因特征的单细胞热图,并说明了ILC1亚群的高异质性和复杂性。这些数据证明了单细胞多组学方法在筛选大量蛋白质和基因以及发现高度异质样品中定义和区分独特细胞亚群所需的关键标记物方面的能力。
在经测试的42个AbSeq标记物中,本研究发现13个表面标记物在三个ILC1亚群之间出现了差异性表达。同时,还发现了表面蛋白CD63的一个差异表达基因(CD63)编码。而且,根据从所生成的多组学数据中获得的知识,设计了一个21色流式细胞术组合方案,用于快速分析固有淋巴细胞的多个样品(数据未显示)。
总结
本研究中,建立了一个完整的流程,以便深入研究循环人类固有淋巴细胞的特征。细胞分选有助于使总固有淋巴细胞纯化,从而能够同时对42个蛋白质和399个基因的表达进行下游分析。单细胞多组学分析揭示了复杂免疫表型和分子特征,从而完善了三个主要固有淋巴细胞组的特性。该分析还揭示了ILC1细胞内的异质性,从而发现了定义不同ILC1细胞群的标记物。单细胞多组学筛选提供的生物学信息有助于设计一个高参数流式细胞术组合方案,可将该试剂盒用于深入分析多个供体的ILC1细胞。有关更多详细信息,请下载详细说明上述研究的固有淋巴细胞数据表。
代谢疾病研究
采用单细胞多组学方法研究肥胖小鼠模型的免疫细胞特征
肥胖是各种疾病恶化的主要危险因素,如2型糖尿病、心血管疾病和癌症。从单纯肥胖到疾病状态的转变与局部和全身炎症的增加有关,而且还以免疫细胞数量和功能的改变为标志。巨噬细胞是脂肪组织炎症的重要来源,在动物模型中,T细胞群的一些变化也与肥胖的发展有关。通过在单细胞水平上对mRNA和蛋白质表达进行综合分析,可以更深入地了解高脂饮食(HFD)如何诱导炎症和最终导致肥胖相关疾病。这里有一个例子:采用小鼠肥胖模型,可使用BD生物科学公司的流式细胞术和单细胞分析工具来研究免疫细胞。
实验大纲
该研究中,从采用不同饮食方案喂养的小鼠的多个组织中提取了大约20,000个单细胞,分析了30种蛋白质和399个靶向mRNAs。通过分析细胞分化和活化标志物,检测了与高脂饮食相关的许多细胞室以及观察到的明显改变。高脂饮食组和对照饮食组的小鼠来自Jackson实验室。将7周大的小鼠分到对照饮食组或高脂饮食组中,持续喂养17周。从骨髓、胸腺、脾脏和附睾脂肪组织制备单细胞悬液。采集和分离组织后,采用BD®小鼠免疫单细胞复用试剂盒的12种独特DNA标记抗体和30种BD®AbSeq小鼠抗体之一,对图中所示的8个样品进行染色。在脂肪组织细胞的染色中,包括BD Pharmingen™ FITC大鼠抗小鼠CD45抗体,并且在BD FACSAria™融合细胞分选仪上分选CD45+细胞。将这八个样品汇集和装入BD Rhapsody™ 单细胞分析系统上。检索样品发现,已建立BD®AbSeq(样品标签)和mRNA(BD Rhapsody™ 小鼠免疫反应流式方案)库,可用于测序。采用BD Rhapsody™ 分析流程和SeqGeq™ 软件,对测序结果进行了分析。

A. 实验概述和BD Rhapsody™系统工作流程。B. 本研究中使用的BD®AbSeq抗体列表
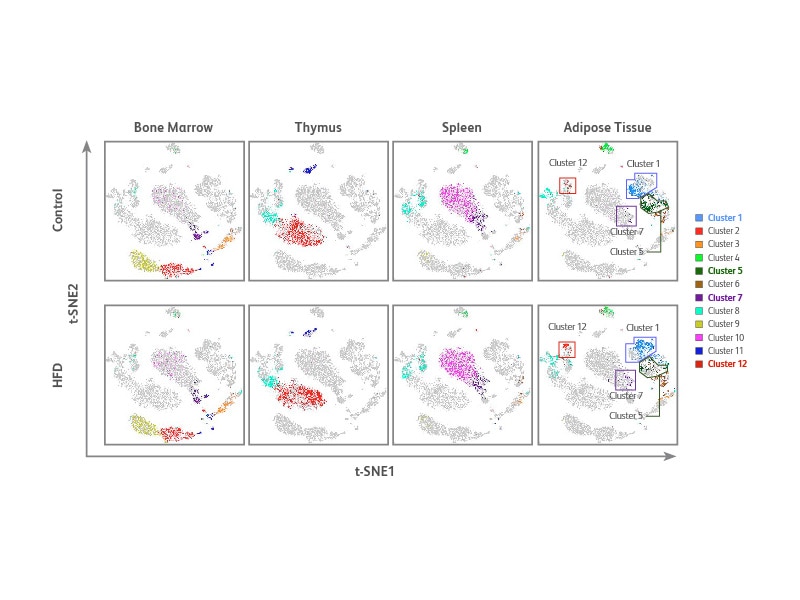
无偏细胞聚类可识别不同样品的多种细胞表型
采用上述实验产生的多组分数据和无偏聚类算法PhenoGraph SeqGeq™ 软件插件,生成了t-SNE,以便用于检测细胞群。PhenoGraph确认了四种不同组织类型的12个细胞簇。与对照细胞簇1、5、7和12相比,这12个细胞簇中有4个细胞簇的细胞密度和HFD小鼠脂肪组织分布存在显著差异。
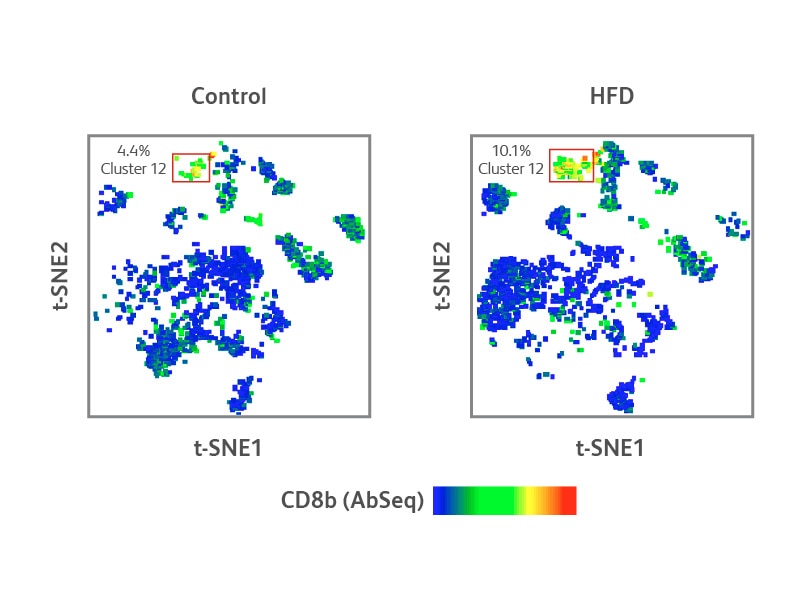
对照组与高脂饮食组小鼠脂肪组织中CD8+T细胞的单细胞蛋白和靶向mRNA序列分析
细胞簇12的特征表明,CD8b在这些细胞表面的表达水平较高,表明该细胞簇主要由CD8+T细胞组成。值得注意的是,高脂饮食组小鼠细胞簇12的CD8+T细胞浓度高于对照组。该细胞簇的差异性mRNA和蛋白质表达分析表明Pdcd1(CD279,PD-1 mRNA)、Lag3和Tigit的表达升高,这是细胞经历衰竭的假定标志物(下图B)。
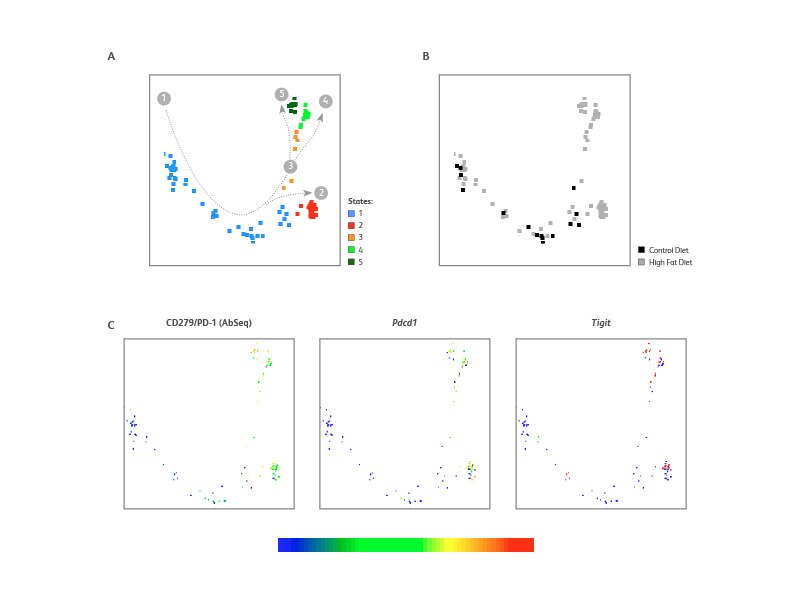
对高脂饮食组脂肪组织CD8+T细胞的单核分析表明,这些细胞经历了细胞衰竭。
采用Monocle对脂肪组织CD8+T细胞进行了特别分析,鉴别出了五中发展状态。对照组小鼠的CD8+T细胞属于状态1和状态2,而高脂饮食组小鼠的CD8+T细胞则进一步遵循状态3、状态4和状态5的轨迹。高脂饮食组小鼠的状态2、状态3、状态4和状态5表现出衰竭标记物的高表达,如CD279(PD-1)蛋白和mRNA(Pdcd1)以及Tigit。
总结
这些结果表明,采用BD®AbSeq抗体和BD Rhapsody™ 小鼠免疫反应流式方案,在BD Rhapsody™ 单细胞分析系统上进行的单细胞分析提供了对肥胖等代谢紊乱的独特见解。该全面单细胞分析平台以及强大的生物信息学工具,有助于揭示独特疾病状态免疫细胞的特征,包括CD8+T细胞衰竭的迹象以及有关高脂饮食诱导炎症的其它新见解。
要了解更多信息,请下载详细说明上述研究的肥胖诱导炎症研究数据表。
仅供研究使用,不用于诊疗程序。
Dynabeads是Thermo Fisher Scientific的商标。HetaSep是STEMCELL Technologies Canada Inc.的商标。