Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current country site or be switched to your country?

自身免疫
免疫系统能够识别致病侵入物,并引发特异性及适当的免疫应答。当免疫系统无法区分自体与异体,并引发本应用于保护宿主免受抗原侵害的反应时,就会引起自身免疫性疾病。有几种预防机制可用来防止自身免疫,使系统对自身分子免疫耐受。当免疫耐受受到破坏时,就会产生自身免疫。自身免疫性疾病可能会局限于特定器官(类风湿性关节炎(RA)),也可能是全身性疾病(系统性红斑狼疮(SLE))。人们已经区分了大约100种不同的自身免疫性疾病,其中最常见的是I型糖尿病(T1D)、类风湿性关节炎、系统性红斑狼疮、炎性肠病(IBD)和多发性硬化症(MS)。1
什么是免疫耐受的破坏?
免疫耐受是指免疫系统对自身分子、细胞或组织的免疫耐受能力。在健康个体中,胸腺中会通过阴性选择,去除具有攻击自身分子倾向的淋巴细胞(中枢耐受)。在离开胸腺后,成熟的T细胞还会经过外周耐受机制的筛选,通过这种机制,大多数会生产自体免疫反应的T细胞都会被剔除。对于表达抗自身表面抗原抗体的B细胞,则会通过克隆清除过程予以去除。此外,调节性T细胞(Tregs)有助于维持外周免疫耐受。即使在这种严格的控制下,一些自身反应T细胞和B细胞也会到外周。虽然在大多数情况下它们是无害的(生理性自身免疫),但它们可能导致先天性和适应性免疫的严重失调,导致组织损伤(病理性自身免疫)1
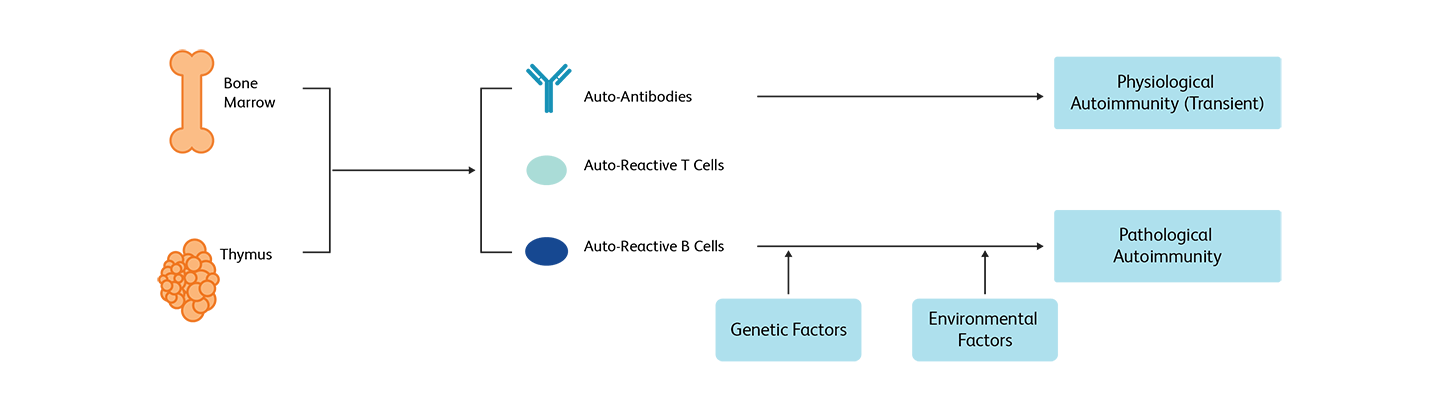
不同自身免疫性疾病的靶点及免疫监测
由于不同自身免疫疾病的靶点不同,每种疾病都有其独特的免疫应答。
I型糖尿病(T1D)
I型糖尿病发病时,免疫系统会攻击胰腺中产生胰岛素的β细胞。一些免疫生物标记物与I型糖尿病有关,如HLA基因型和自身抗体等,但大多数都不能用于辨别I型糖尿病。由于T细胞是以胰腺β细胞为靶点进行破坏时的免疫组分,结合T细胞和B细胞图谱分析自身抗体可提供更多关于疾病特征的信息,并有助于监测疾病演变和治疗反应。2
类风湿性关节炎
类风湿性关节炎发病时,关节周围的滑膜受到免疫细胞的攻击,从而引起肿胀、疼痛和炎症。这种慢性炎症反应使滑膜增厚,导致僵硬,限制关节的正常活动,并可使关节逐渐变形,破坏关节软骨及骨骼。在发病前,可借助抗瓜氨酸抗体和类风湿因子(RF)的存在判定类风湿性关节炎,其存在于大多数类风湿性关节炎病例中。在类风湿性关节炎的不同阶段,可以在滑膜中检测到髓样细胞,特别是巨噬细胞、B细胞系以及细胞因子图谱。3,4 促炎细胞因子,如肿瘤坏死因子(TNF)在类风湿性关节炎的发病机制中会起一定作用。使用抗肿瘤坏死因子受体有助于使肿瘤坏死因子在生物学上失去活性,降低其炎症活性。5
系统性红斑狼疮
系统性红斑狼疮是B细胞稳态改变最多的自身免疫性疾病。其初步诊查变化包括B淋巴细胞减少,CD27+及CD27-B细胞的绝对数量减少,IgD+ CD27+记忆性B细胞的比例降低。几乎所有系统性红斑狼疮患者都存在UM B细胞消失的情况。因此,B细胞图谱分析与抗核抗体(ANA)阳性等其他临床参数相结合,有助于识别狼疮相关的潜在生物标记物。4,6
多发性硬化症
多发性硬化症是一种导致中枢神经系统(CNS)损害的脱髓鞘性自身免疫性疾病。多发性硬化症与特殊的细胞因子标记有关。流式细胞技术可以检测到细胞表面标记物,如CD74(MHC II类不变链),不仅可以评估疾病的活动进展,而且还可以评估临床疗效。7 其他标记物,如血液中CD19+ CD5+ B细胞和CD8+穿孔素+ T淋巴细胞的百分比,也可以预测对干扰素β的反应。8 此外,CD19和CD20计数也可作为临床医生评价利妥昔单抗(一种针对CD20+ B细胞的单克隆抗体)治疗效果的指标。9
自身免疫研究过程中的流式细胞技术测定
流式细胞术通常用于研究自身免疫病。总T和B淋巴细胞百分比以及免疫细胞比率(CD4/CD8、抑制细胞/细胞毒性细胞),用于描述某些类型的自身免疫疾病。单克隆抗体的特异性使流式细胞技术成为研究疾病特异性生物标记物的可靠方法。对于免疫监测研究来说,流式细胞技术是CD4+/CD8+(辅助/抑制)细胞毒性T淋巴细胞比率评估、自身抗体检测以及HLA-DR+T淋巴细胞测定的理想方法。
随着人们对B细胞在自身免疫性疾病发病机制中作用的认识不断加深,靶向B细胞也成为了治疗自身免疫性疾病的一种常用方法。可以将记忆及效应B细胞作为靶点来阻止致病性抗体的产生,进而阻断细胞因子的合成。抗CD20单克隆抗体可用于特异性靶向记忆B细胞,同时保留原初B细胞和浆细胞。10 可通过有效设计流式细胞仪检测组套,在分化后期鉴定B细胞,并对T CD4+/CD8亚群进行计数。11
流式细胞技术还可用于检测其他有用的生物标记物,如TCRα/β DN T细胞(在自身免疫性淋巴增生综合征(ALPS)中升高),FOXP3+CD25+CD4+ 调节性T细胞群(在由脂多糖应答和米色锚蛋白(LRBA)突变引起的常见变异型免疫缺陷病(CVID)样疾病中减少)以及FOXP3+CD25+细胞群(在一些由STAT3基因突变引起的自身免疫性淋巴增生综合征中减少)。12 流式细胞技术目前是了解自身免疫综合征的有力工具。
BD Biosciences自身免疫研究工具
BD Biosciences提供了各种各样的研究用细胞流式分析仪,适用于各类常规研究应用;同时还提供了先进的研究用高参数细胞分析仪,适于解析、分析稀有细胞群以及异质细胞群的独特表型。
BD® Small Batch Reagents经过预分装、预配制,可随时使用;充分利用BD Horizon™ Dri Technology技术,能够高效表征多种免疫亚群。BD Horizon™ Dri TBNK + CD20 Panel可用于表征B细胞,并在临床研究中评估CD20清除疗法的免疫应答。BD Horizon™ Dri Treg Panel可用于表征FoxP3+原初、过渡以及效应调节性T细胞亚群。
BD Simultest™ Antibodies可用于同时分析两个或多个标记物。
我们提供的BD Horizon™ Dyes以及BD Horizon™ Antibodies超过9,000种,能够帮您为各种免疫标记物表征设计最优的检测panel.这 些产品是表征表面受体较少的免疫细胞的理想材料,较高的亮度让您很容易就能从样本中的其他细胞中区分出这些表达量较低的细胞。
参考
- Wang L, Wang F-S, Gershwin ME. Human autoimmune diseases: a comprehensive update. J Intern Med. 2015;278(4):369-95. doi: 10.1111/joim.12395
- Notkins AL, Lernmark A. Autoimmune type 1 diabetes: resolved and unresolved issues. J Clin Invest. 2001;108(9):1247-1252. doi: 10.1172/JCI14257
- Firestein GS, McInnes IB. Immunopathogenesis of rheumatoid arthritis. Immunity. 2017;46(2):183-196. doi: 10.1016/j.immuni.2017.02.006
- Wei C, Jenks S, Sanz I. Polychromatic flow cytometry in evaluating rheumatic disease patients. Arthritis Res Ther. 2015;17(1):46. doi: 10.1186/s13075-015-0561-1
- Zhao S, Mysler E, Moots RJ. Etanercept for the treatment of rheumatoid arthritis. Immunotherapy. 2018;10(6):433-445. doi: 10.2217/imt-2017-0155
- Nagafuchi Y, Shoda H, Fujio K. Immune profiling and precision medicine in systemic lupus erythematosus. Cells. 2019;8(2):140. doi: 10.3390/cells8020140
- Benedek G, Meza-Romero R, Bourdette D, Vandenbark AA. The use of flow cytometry to assess a novel drug efficacy in multiple sclerosis. Metab Brain Dis. 2015;30(4):877-884. doi: 10.1007/s11011-014-9634-0
- Villarrubia N, Rodríguez-Martín E, Alari-Pahissa E, et al. Multi-centre validation of a flow cytometry method to identify optimal responders to interferon-beta in multiple sclerosis. Clin Chim Acta. 2019;488:135-142. doi: 10.1016/j.cca.2018.11.008
- Barra ME. Experience with long-term rituximab use in a multiple sclerosis clinic. Mult Scler J Exp Transl Clin. 2016;2:2055217316672100. doi: 10.1177/2055217316672100
- Du FH, Mills EA, Mao-Draayer Y. Next-generation anti-CD20 monoclonal antibodies in autoimmune disease treatment. Autoimmunity Highlights. 2017;8:12.
doi: 10.1007/s13317-017-0100-y
- Gatti A, Buccisano F, Scupoli M, Brando B. The ISCCA flow protocol for the monitoring of anti-CD20 therapies in autoimmune disorders. Cytometry. 2020. 1-12. doi: 10.1002/cyto.b.21930
- Cabral-Marques O, Schimke LF, de Oliveira EB, Jr, et al. Flow cytometry contributions for the diagnosis and immunopathological characterization of primary immunodeficiency diseases with immune dysregulation. Frontiers in Immunol. 2019;10:2742. doi: 10.3389/fimmu.2019.02742
用于自身免疫类BD工具仅供研究使用。不用于诊疗程序。
Report a Site Issue
This form is intended to help us improve our website experience. For other support, please visit our Contact Us page.