Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current country site or be switched to your country?

免疫学
健康的免疫系统会通过先天免疫及适应性免疫发挥功能,抵抗抗原,区分自体与异体,记住以前的感染,一旦病原体从系统中清除,就停止攻击。各种类型的免疫细胞,借助复杂的结构与精密的调节,使身体能够维持体内平衡,并根据需要激活适应性免疫应答。通过流式细胞技术,您可以精确、快速地分析大量免疫细胞,对其进行计数和表征,识别免疫亚型的特定表面和细胞内标记物,并评估术后免疫细胞的消耗情况。
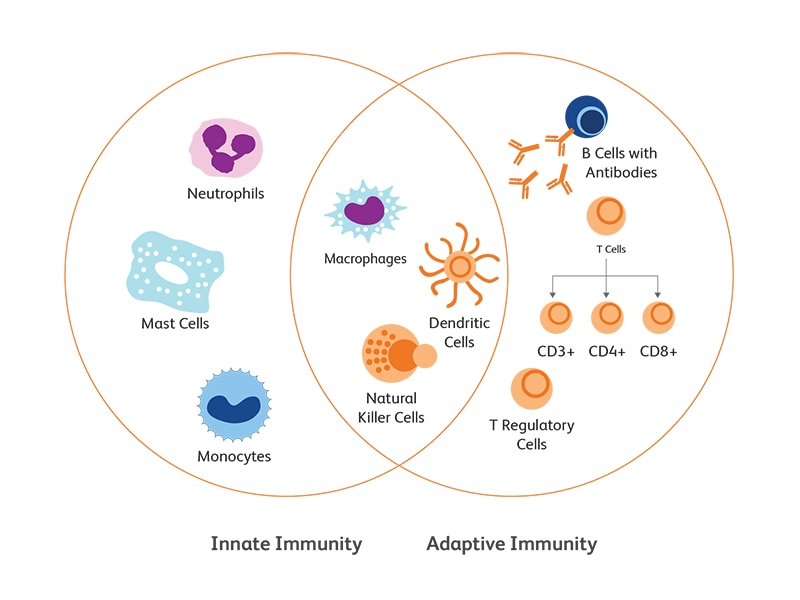
先天性与适应性免疫应答
先天免疫是机体通过识别病原体的保守特征,对病原体攻击作出的基本且迅速的细胞反应。与微生物相关的分子模式识别是由模式识别受体(PRR)介导的,模式识别受体包括表面受体(Toll样受体(TLR)和c型凝集素受体(CLR)),或细胞质受体(TLR,核苷酸结合寡聚结构域(Nod)-富含亮氨酸重复序列的受体(NLR))、RIG-I样受体(RLRs)。模式识别受体能够识别微生物病原体的两种配体:保守结构,即病原体相关分子模式(PAMP);以及自体改变危险信号,即危险相关分子模式(DAMP)。模式识别受体通过其配体的激活进行固有免疫细胞的动员以及信号和效应分子(细胞因子和抗菌肽)的分泌,从而诱发炎症反应,以消除病原体或缓解危险。1 这种一线反应通常是触发机体适应性免疫原初反应的先决条件。
适应性免疫是通过 B淋巴细胞(体液)上的IgGs(B细胞受体)和 T淋巴细胞(介导细胞)上的T细胞受体(TCR)诱导的。通过可变(V)、多样性(D)和连接(J)基因片段的组装进行体细胞重组,可以让Ig重链和TCRβ链基因的抗原识别具有惊人的多样性。
先天免疫细胞
先天免疫系统主要由单核细胞、巨噬细胞、粒细胞、自然杀伤细胞和树突状细胞组成。
单核细胞
单核细胞是血液中最大的免疫细胞。它们在体内巡逻,为抵御细菌和真菌入侵提供第一道防线,可以通过细胞因子分泌引发炎症,并触发适应性免疫。单核细胞的类型包括以CD14+CD16-(人类)、CCR2+Ly6CHigh(小鼠)为特征的经典或炎性单核细胞,以及表达CD14Low CD16+(人类)、CCR2Low Ly6CLow(小鼠)的侦查型单核细胞。2
巨噬细胞
巨噬细胞的一个特征是其支持清除入侵者和启动免疫应答的吞噬能力。然而,巨噬细胞也能实现其他必要的稳态功能,如代谢。3 巨噬细胞高度参与肿瘤的发生和发展,因为肿瘤相关巨噬细胞(TAM)可分泌对肿瘤细胞免疫耐受的诱导因子。因此,它们在免疫肿瘤学中非常重要,并且是研究评估治疗对肿瘤微环境(TME)影响的核心内容。人们根据刺激诱导极化M1与M2,将巨噬细胞分为两大类型。M1巨噬细胞具有促炎症作用,可以促进氧化状态、产生活性氧(ROS),并分泌炎症细胞因子和趋化因子,如IL-1、IL-6、IL-12、TNF-α、CXCL9、CXCL10。M2巨噬细胞被认为具有免疫抑制作用,分泌IL-10和TGF-β等抗炎因子。4
粒细胞
粒细胞是富含细胞质颗粒的细胞,包括嗜碱性粒细胞5、嗜中性粒细胞6,7、嗜酸性粒细胞8以及肥大细胞。9粒细胞支持一系列保护功能,包括吞噬功能(嗜中性粒细胞)防御寄生虫(嗜碱性粒细胞)以及作为变态反应的效应物(肥大细胞),并且还能在免疫治疗期间调节宿主的反应。
自然杀伤细胞
自然杀伤细胞是一类先天免疫细胞,但在形态上及淋巴标记物表达上,与淋巴细胞相似。NK细胞的特征性标记物包括人CD16、CD56以及小鼠NK1.1。10, 11
树突状细胞
树突状细胞(DC)作为一种专业的抗原提呈细胞,通过对T、B淋巴细胞的抗原加工和提呈,将先天免疫和适应性免疫联系起来。树突状细胞主要分为三类:
- 浆细胞样树突状细胞(pDC),专精于识别病毒和肿瘤细胞
- I型经典树突状细胞(cDC1),能够识别细胞内病原体并触发CD8 T 细胞和Th1 CD4 T细胞应答
- II型经典树突状细胞(cDC2),在与细胞内病原体、寄生虫、变应原、真菌和细胞外细菌接触时,会触发CD4 T细胞反应
树突状细胞的常规标记物包括CD11c、BDCA-1/2以及CD123。12, 13
什么是训练免疫?
训练免疫或者先天免疫记忆,属于先天免疫细胞的特性,其通过适应宿主的应答,从而提高对以往入侵者的抵御力。14虽然这种应答的特异性仍低于适应性免疫记忆,但是通过参与不同类型的模式识别受体(PRRs),可以广泛识别各类病原体,如革兰氏阳性细菌和革兰氏阴性细菌。
适应性免疫细胞
B淋巴细胞和T淋巴细胞是适应性免疫能力的主要组成部分。并且对病原体启动一种延迟但是更具特异性的免疫应答。15.16
T 淋巴细胞
T细胞 起源于骨髓,然后转移到胸腺中发育成熟。T细胞的特征标记物包括CD3和T细胞受体(TCR)。根据表达类型,它们随后被分为其他表面分子CD4(CD4+ T细胞)和CD8(CD8+ T细胞)。表面和细胞内标记物的流式细胞仪筛查,可以区分T细胞亚群的表型和功能:Th1(CD3、CD4、IFN-g、CCR5、CXCR3);Th2(CD3、CD4、CCR3、CCR4、CXCR4、IL-4、IL-10);Th17(CD3、CD4、CCR4、CCR6、TGFbRII、IL-17、CCL20);CD8+细胞毒性T细胞, T-reg或调节性T细胞(CD3、CD4、FoxP3、CD25、CTLA4、OX40/CD134、TGFb、IL-10、IL-35)。17
B 淋巴细胞
B淋巴细胞 或 B细胞 在骨髓中开始发育成熟。众所周知,B细胞能够通过产生抗体来支持体液免疫,但是它们还具有其他的关键功能,比如吞噬功能和交叉呈递功能。与其他淋巴细胞一样,B细胞的标记物也在成熟和分化过程中发生进化,包括CD19、CD27 BCM和CXCR4。18
补体系统
随着先天性和适应性免疫应答的增加,它们收到来自其他生理系统和生理过程(包括补体系统)的支持。补体系统是一个由膜结合蛋白和可溶性蛋白因子组成的网络,蛋白因子主要通过以下三种途径激活:由C -反应蛋白(CRP)诱发的经典补体途径、由收集和甘露糖结合凝集素(MBL)诱发的凝集素途径以及替代补体途径。补体级联反应的激活,最终导致细胞溶解。19
参考
- Romo MR, Pérez-Martínez D, Ferrer CC. Innate immunity in vertebrates: an overview. Immunology. 2016;148(2):125-139. doi:10.1111/imm.12597
- Heung LJ. Monocytes and the host response to fungal pathogens. Front Cell Infect Microbiol. 2020;10:34. doi:10.3389/fcimb.2020.00034
- Mosser DM, Hamidzadeh K, Goncalves R. Macrophages and the maintenance of homeostasis [published online ahead of print, 2020 Sep 15]. Cell Mol Immunol. 2020;1-9. doi:10.1038/s41423-020-00541-3
- Petty AJ, Yang Y. Tumor-associated macrophages in hematologic malignancies: new insights and targeted therapies. Cells. 2019;8(12):1526. doi:10.3390/cells8121526
- Chirumbolo S, Bjørklund G, Sboarina A, Vella A. The role of basophils as innate immune regulatory cells in allergy and immunotherapy. Hum Vaccin Immunother. 2018;14(4):815-831. doi:10.1080/21645515.2017.1417711
- Liew PX, Kubes P. The neutrophil's role during health and disease. Physiol Rev. 2019;99(2):1223-1248. doi:10.1152/physrev.00012.2018
- Silvestre-Roig C, Fridlender ZG, Glogauer M, Scapini P. Neutrophil diversity in health and disease. Trends Immunol. 2019;40(7):565-583. doi:10.1016/j.it.2019.04.012
- Simon HU, Yousefi S, Germic N, et al. The cellular functions of eosinophils: Collegium Internationale Allergologicum (CIA) Update 2020. Int Arch Allergy Immunol. 2020;181(1):11-23. doi:10.1159/000504847
- Mukai K, Tsai M, Saito H, Galli SJ. Mast cells as sources of cytokines, chemokines, and growth factors. Immunol Rev. 2018;282(1):121-150. doi:10.1111/imr.12634
- Abel AM, Yang C, Thakar MS, Malarkannan S. Natural killer cells: development, maturation, and clinical utilization. Front Immunol. 2018;9:1869. doi:10.3389/fimmu.2018.01869
- Vivier E, Raulet DH, Moretta A, et al. Innate or adaptive immunity? The example of natural killer cells. Science. 2011;331(6013):44-49. doi:10.1126/science.1198687
- Collin M, Bigley V. Human dendritic cell subsets: an update. Immunology. 2018;154(1):3-20. doi:10.1111/imm.12888
- Takenaka MC, Quintana FJ. Tolerogenic dendritic cells. Semin Immunopathol. 2017;39(2):113-120. doi:10.1007/s00281-016-0587-8
- Netea MG, Joosten LA, Latz E, et al. Trained immunity: A program of innate immune memory in health and disease. Science. 2016;352(6284):aaf1098. doi:10.1126/science.aaf1098
- Netea MG, Schlitzer A, Placek K, Joosten LAB, Schultze JL. Innate and adaptive immune memory: an evolutionary continuum in the host's response to pathogens. Cell Host Microbe. 2019;25(1):13-26. doi:10.1016/j.chom.2018.12.006
- Flajnik MF. A cold-blooded view of adaptive immunity. Nat Rev Immunol. 2018;18(7):438-453. doi:10.1038/s41577-018-0003-9
- Mousset CM, Hobo W, Woestenenk R, Preijers F, Dolstra H, van der Waart AB. Comprehensive phenotyping of T cells using flow cytometry. Cytometry A. 2019;95(6):647-654. doi:10.1002/cyto.a.23724
- Martínez-Riaño A, Bovolenta ER, Mendoza P, et al. Antigen phagocytosis by B cells is required for a potent humoral response. EMBO Rep. 2018;19(9):e46016. doi:10.15252/embr.201846016
- Lubbers R, van Essen MF, van Kooten C, Trouw LA. Production of complement components by cells of the immune system. Clin Exp Immunol. 2017;188(2):183-194. doi:10.1111/cei.12952
仅供研究使用,不用于诊疗程序。
Report a Site Issue
This form is intended to help us improve our website experience. For other support, please visit our Contact Us page.