Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current country site or be switched to your country?

免疫监测
临床研究期间,通过监测免疫系统评估治疗前或治疗期间健康及疾病的反应与变化。 采用这种免疫系统监测方法可为多个免疫学研究领域提供支持,如免疫肿瘤学、变态反应和自身免疫,还可以监测致病性感染相关免疫应答,如HIV、新冠肺炎病毒等。人们对于免疫治疗介导应答过程中的抗肿瘤免疫的认识不断提高,因此有效监测免疫应答的需求也在稳步增加。BD Biosciences为主动免疫监测相关临床研究提供了多种工具。
免疫监测的应用
移植研究过程中的耐受监测
临床研究中广泛采用免疫监测,以期深入了解导致移植耐受的免疫机制。例如,在肝脏移植试验中,可以使用调节性T细胞、γδT细胞或自然杀伤(NK)细胞的标记物,在外周血中监测被动耐受情况,如自发操作性耐受(SOT)。在肾移植试验中,可以用过渡细胞以及IL10 + 颗粒酶B + 调节性B细胞来监测。1
免疫肿瘤学及免疫治疗评价
在免疫治疗研究方案中,可以利用免疫监测在细胞群以及单细胞层次上评估免疫应答的反应情况。主要的免疫治疗策略,包括CAR T细胞治疗、移植与免疫检查点抑制剂,都可以在干预前、干预中以及干预后使用免疫监测工具获得改善,可以借此了解治疗过程的状态、了解分子特征,进而可以制定分层精准医疗策略。2,3
精准医疗试验过程中的免疫监测
免疫监测工具还可用于生物/生物仿制药临床试验前所需的临床研究,以评估长期安全性和患者特异性治疗策略,进而为实施精准医疗方案提供支持。4 对于TH2内型哮喘,监测免疫生物标记物(如骨膜素和嗜酸性粒细胞增多),可以为针对TH2免疫应答成分进行治疗提供一定的指导。在变态反应研究过程中,可以利用免疫监测为制定病情发展抑制策略提供支持,同时还能借此确定理论阈值,以进一步研究患者特有的变应原剂量递增时间表。
变态反应研究中的免疫监测
变态反应涉及不同的免疫细胞群,包括抗原提呈细胞(如树突状细胞)、肥大细胞、产生Ig-E的B细胞和T细胞。根据所涉及的免疫细胞(如IgG、IgM或抗原特异性T细胞)和释放的细胞因子(如IL-4、IL-5),可划分出不同类型的过敏性超敏反应。变态反应也可以是非IgG介导的。检测血清细胞因子、补体激活或线粒体功能是在免疫监测研究过程中检测变态反应的部分策略。5,6
自身免疫研究过程中的免疫监测
当免疫系统无法区分自体与异体,并引发本应用于保护宿主免受抗原侵害的反应时,就会引起自身免疫性疾病。随着人们对B细胞在自身免疫性疾病发病机制中作用的认识不断加深,靶向B细胞也成为了治疗自身免疫性疾病的一种替代方法。可以将记忆及效应B细胞作为靶点来阻止致病性抗体的产生,进而阻断细胞因子的合成。B细胞在自身免疫研究中的应用越来越广泛。7
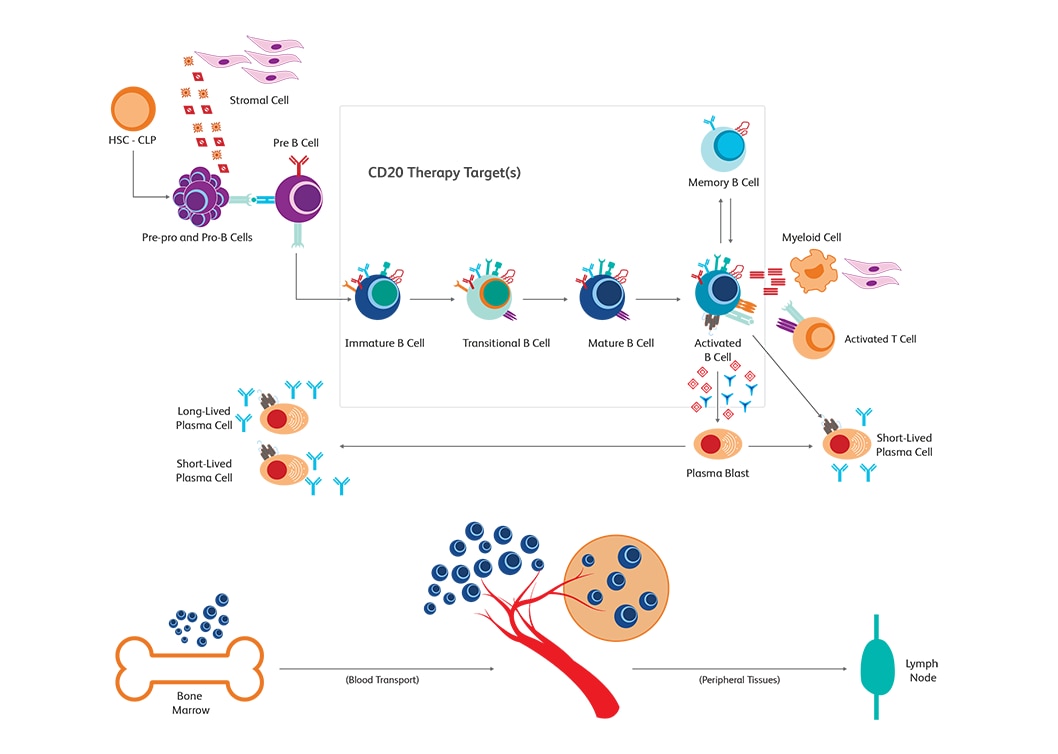
B细胞清除的临床研究有助于了解肿瘤学和自身免疫的疾病途径。
免疫肿瘤学监测过程中的免疫监测
肿瘤微环境(TME)在肿瘤的维持和治疗反应中起着至关重要的作用。肿瘤微环境是由肿瘤本身、周围环境和所有相互作用的细胞组成的,肿瘤可以通过改变这些细胞和细胞过程实现存活。其中包括癌干细胞、浸润性免疫细胞、携带营养物质的血管、信号分子以及可以协助癌细胞迁移到其他部位的细胞外基质(ECM)。8
代谢研究过程中的免疫监测
免疫监测有助于了解肿瘤代谢和免疫抑制肿瘤微环境的代谢占比。营养物质获取使肿瘤能够获得迅速生长所必需的补给,并借此调节关键的代谢途径(例如胆固醇合成、线粒体能量产生、葡萄糖代谢),控制肿瘤微环境免疫细胞的各种功能。肿瘤细胞和T细胞之间竞争相同的营养素导致肿瘤微环境中的免疫细胞功能出现代谢重新编程。代谢疗法(例如,用于脂代谢的COX抑制剂、用于糖代谢的mTOR抑制剂)可以改变肿瘤微环境中的可用营养素,并且已经证明可以重新编程肿瘤浸润的T细胞并增强抗肿瘤免疫能力。对肿瘤浸润性免疫细胞进行免疫监测,可以了解这些细胞的表型和功能,同时了解肿瘤微环境中的免疫活动,所有这些都会影响肿瘤负荷以及对治疗的反应。9
免疫监测面临着哪些挑战?
存档样本与新鲜样本
免疫细胞标记物的免疫监测具有一定的挑战性,具体取决于所检查的材料及其制备过程。例如,冷冻保存可以改变表面蛋白质的构象,使其更难通过免疫染色检测;因此,在一些实验过程中,会优先对新鲜材料进行实验,因为新鲜材料更能代表存活条件。10 样本制备方法也会影响样本产量以及后续实验的质量。BD Biosciences提供可用于收集、处理以及分离标本的各种解决方案。BD Horizon™ Dri Tumor & Tissue Dissociation Reagent (TTDR)能够实现温和、有效的解离,同时还能保存良好的抗原表位。TTDR可实现细胞产量最大化,同时还能尽量减少细胞死亡数量,从而可以对多种类型的肿瘤类型进行有效解离,便于进行单细胞研究。
待评估标记物的状态
在转化免疫肿瘤学研究中,配对样本评估为研究治疗诱导的免疫应答、评估原初诊断时的静态标记物和整个治疗过程中的动态标记物提供了一种比较方法。任何免疫监测工具都应该能够评估这些标记物的确切状态,但实现起来却并非易事。
材料或样本丰度
样本的丰度和存活能力在实验设计中起着至关重要的作用,可能会限制实验的范围。多色流式细胞技术能够同时评估多种标记物,充分利用样本。适当地设计检测组套有助于有效地利用珍贵的样本。BD Biosciences提供了一些检测组套设计工具和资源,能够让这一过程变得更容易。
免疫监测研究工具
流式细胞技术
细胞表面标记经常用于监测细胞亚群的异质性。11,12,13
免疫组织化学
免疫组织化学(IHC)是一种免疫染色技术,即利用特异性抗体的能力来检测组织样本中待研究的抗原。在许多研究领域和各种疾病的临床研究中经常会用到免疫组织化学。与显微镜技术相结合,可以在固定或活体生物样本中显示染色免疫细胞。
单细胞多组学
借助单细胞多组学可以深入分析各种应用,包括免疫学、肿瘤学和新陈代谢。BD Biosciences提供了各种单细胞多组学工具,如BD Rhapsody™ Single-Cell Analysis System和BD® AbSeq Assays,将RNA和蛋白质生物标记物表达和强大的生物信息学工具结合在一起,如FlowJo™ v10 Software和SeqGeq™ v1.6 Software,可以帮您获取多组学数据并从中得出有用的见解。
免疫监测研究过程中的测定
BD提供了一整套试剂和试剂盒,方便您借助一系列技术从不同角度对免疫细胞进行研究。在各类免疫监测方法中,最突出的就是是多色流式细胞技术——因为它能够从功能和表型两方面检定高度复杂亚群的特性。结合其他互补性技术,如ELISA、ELISPOT以及BD® Cytometric Bead Array,可以捕获很多从多色流中得不到的信息,如分泌分子的水平。
BD Horizon™ Dri TBNK + CD20多色流式方案针对免疫监测研究进行了优化。从免疫应答监测到CD20清除疗法的各类研究及临床试验中,这种试剂都得到了应用。该检测组套能够检测T细胞、B细胞以及NK细胞。Dri设计免除了手动移液,提高了效率,并且能够在与BD Trucount™ Tubes配对时实现绝对计数。
针对细胞治疗研究以及免疫系统研究,对7色BD Horizon™ Treg Panel进行了优化。试管内含预等分的干燥多色混合物,包括用于表征FoxP3 + 原初、过渡及效应调节性T细胞(Treg)亚群的标记物。该检测组套在研究及临床研究试验中的应用包括但不限于自身免疫研究、移植研究、肿瘤微环境研究以及感染。
参考
- Sani KB, Sawitzki B. Immune monitoring as prerequisite for transplantation tolerance trials. Clin Exp Immunol. 2017;189(2):158-170. doi:10.1111/cei.12988
- Hartmann FJ, Babdor J, Gherardini PF, et al. Comprehensive immune monitoring of clinical trials to advance human immunotherapy. Cell Rep. 2019;28(3):819-831.e4. doi:10.1016/j.celrep.2019.06.049
- Przespolewski A, Szeles A, Wang ES. Advances in immunotherapy for acute myeloid leukemia. Future Oncol. 2018;14(10):963-978. doi: 10.2217/fon-2017-0459
- Seyhan A, Carini C. Are innovation and new technologies in precision medicine paving a new era in patients centric care? J Transl Med. 2019;17(1):114. doi: 10.1186/s12967-019-1864-9
- Yu W, Freeland DMH, Nadeau KC. Food allergy: immune mechanisms, diagnosis and immunotherapy. Nat Rev Immunol. 2016;16(12):751-765. doi:10.1038/nri.2016.111
- Simon D, Cianferoni A, Spergel JM, et al. Eosinophilic esophagitis is characterized by a non-IgE-mediated food hypersensitivity. Allergy. 2016;71(5):611-620. doi:10.1111/all.12846
- Du FH, Mills EA and Mao-Draayer Y. Next-generation anti-CD20 monoclonal antibodies in autoimmune disease treatment. Autoimmunity Highlights. 2017;8:12. https://doi.org/10.1007/s13317-017-0100-y
- Arneth B. Tumor microenvironment. Medicina (Kaunas). 2019;56(1):15. doi: 10.3390/medicina56010015
- Cuyàs E, Verdura S, Martin-Castillo B, et al. Tumor cell-intrinsic immunometabolism and precision nutrition in cancer immunotherapy. Cancers (Basel). 2020;12(7):1757. doi:10.3390/cancers12071757
- Wargo JA, Reddy SM, Reuben A, Sharma P. Monitoring immune responses in the tumor microenvironment. Curr Opin Immunol. 2016;41:23-31. doi:10.1016/j.coi.2016.05.006
- Stojanovic I, Ruivo CF, van der Velden TJG, Schasfoort RBM, Terstappen LWMM. Multiplex label free characterization of cancer cell lines using surface plasmon resonance imaging. Biosensors (Basel). 2019;9(2):70. doi: 10.3390/bios9020070
- Sukhdeo K, Paramban RI, Vidal JG, et al. Multiplex flow cytometry barcoding and antibody arrays identify surface antigen profiles of primary and metastatic colon cancer cell line. PLOS One. 2013;8(1):e53015. doi: 10.1371/journal.pone.0053015
- Greve B, Kelsch R, Spaniol K, Eich HT, Götte M. Flow cytometry in cancer stem cell analysis and separation. Cytometry A. 2012;81(4):284-293. doi: 10.1002/cyto.a.22022
仅供研究使用,不用于诊疗程序。
BD Biosciences的临床流式细胞技术解决方案,包括仪器、软件和试剂,为实验室通过测试开发人类疾病识别标记物提供了基础。FDA仍未许可或批准将此类解决方案用于任何疾病的诊断。分析物特定试剂。分析和性能特性尚未确定。
Report a Site Issue
This form is intended to help us improve our website experience. For other support, please visit our Contact Us page.