荧光激活细胞分选与碧迪医疗生物科学:共同发展、相互交织、未来无限
January 09, 2024
荧光激活细胞分选(FACS)彻底改变了使用流式细胞术鉴定、表征和分选细胞的方式。通过使用该技术,科学家无需在暗室中逐个计数细胞,能够快速获得深入的科学见解,且该技术具有将这些见解转化为有意义的临床实践所需的特异性和灵敏度。碧迪医疗生物科学成功将该技术融入可行的商用仪器,并见证了该技术在常规科学实验和临床实践中的广泛应用。在庆祝碧迪医疗生物科学首款FACS仪器上市50周年之际,我们回顾了FACS技术的起源、流式细胞术技术的发展以及FACS在当代推动的巨大科学进步。
与许多突破性发现一样,细胞分选技术起初也很不起眼。该技术起源于洛斯阿拉莫斯国家实验室Mack Fulwyler对库尔特计数器进行的内部改装,该计数器最初用于细胞计数,后将其改装成细胞分选仪1。当细胞通过液流时,其装置采用相同技术,根据电阻差异(与细胞体积的差异成正比)分离出不同类型的细胞。Mack Fulwyler对其进行了改装,将液流分解成单个液滴,并根据其电荷分选细胞。
斯坦福大学遗传学家Leonard “Len” Herzenberg 是一位具有不屈不挠精神的天才,他对Mack Fulwyler开发的简易细胞分选仪进行了调整,并将其改造成了后来的荧光激活细胞分选仪(FACS),这项技术在数年内使生物医学、免疫学研究以及疾病诊断和监测领域发生变革。当时,包括Len在内的免疫学研究者正在暗室中使用免疫荧光技术在显微镜下艰难地计数荧光染色的细胞。为了将免疫荧光与流式细胞术联合用于鉴定和分选细胞,Len采用Fulwyler的细胞分选技术,并将其与斯坦福大学Richard Sweet开发的喷墨打印机技术相结合,制造出了能够根据经荧光染色抗体标记的细胞表面标志物鉴定和分选细胞的细胞分选仪2。Len并未使用静电,而使用了能够检测经中国仓鼠卵巢(CHO)细胞免疫的小鼠脾细胞的光源。他使用荧光素二乙酸酯染料标记生物标志物,并于1969年使用其FACS(荧光激活细胞分选仪),成功根据荧光活性差异从CHO细胞中分选出产生抗体的脾细胞。2从简易细胞分选机到如今的精密细胞分析仪,FACS技术及其对科学发现的推动已突飞猛进。
流式细胞术技术的发展
流式细胞仪是如何从一个只有实验板、示波器屏幕和宝丽来相机的普通装置发展到如今的精密流式细胞仪的?它是如何从研究实验室走向临床,甚至进入国际空间站的?3。这一发展历程需要结合斯坦福大学Len Herzenberg的非凡科学思维与碧迪医疗生物科学公司Bernie Shoor的商业化和工程专业知识。二者的结合使碧迪医疗生物科学得以在五十年前推出首款商用FACS流式细胞仪——BD FACS™ II细胞分选仪。Becton & Dickinson Immunocytometry Systems(现为碧迪医疗生物科学)制造的BD FACS™ II细胞分选仪及其后代产品将在未来数年内为免疫学和医学领域带来科学发现。有趣的是,在1985年,FACS一词由碧迪医疗注册为商标,BD FACS™ II细胞分选仪目前是Smithsonian Institutes收藏馆的一部分!
FACS仪器的核心功能是测量荧光分子染色细胞所发出的光,这些荧光分子在一定范围内由激光激发,并在不同范围内发光。这些发射光谱由具有适当带宽的检测器和滤光片收集,用于检测这些荧光染料的发射峰值。如1883年的出版物4所述,在基于同轴层流动力学特性的流体动力学聚焦后,细胞逐个穿过激光束,以便进行单独分析。首款BD FACS™ II细胞分选仪具有在488 nm处发射单一波长并激发荧光素染料的激光源。将该激光换成氪激光后,可使用荧光素和罗丹明进行双色荧光检测,后来碧迪医疗将其作为BD FACS™ IV流式细胞仪进行市售。20世纪80年代,氪激光先被氦氖激光激发所取代,最终被固态激光所取代。
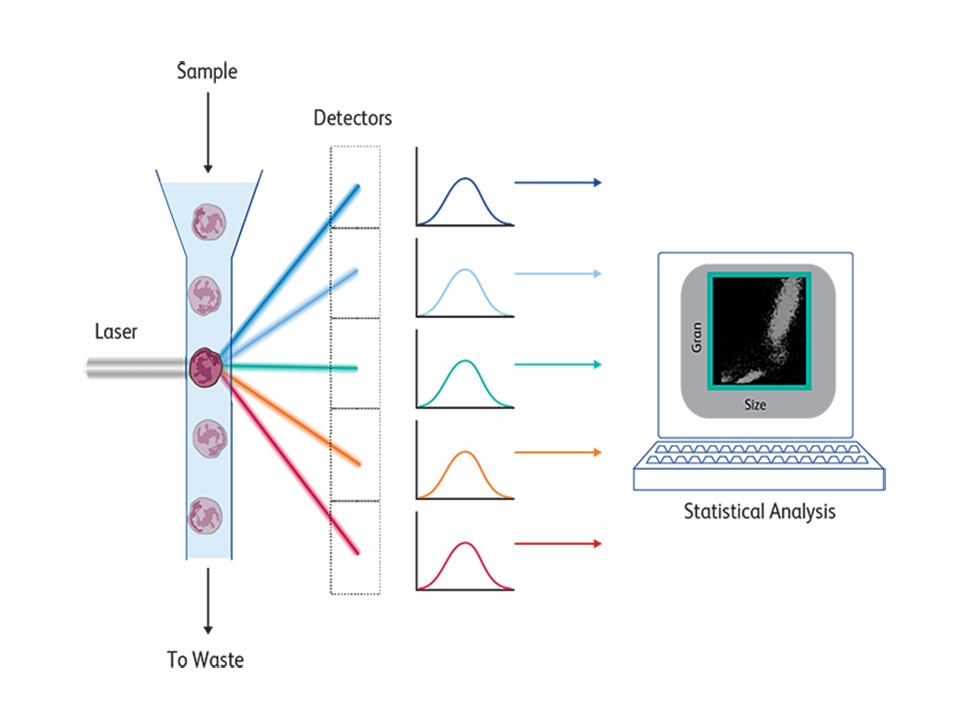
随着对免疫细胞生物学和功能的深入研究,免疫学家开始认识到免疫细胞的复杂性。白细胞本身可表达多种蛋白质,并形成功能各异的亚群。若要鉴定这些不同的免疫亚群并分析其功能影响,需进行高参数分析,为此,技术必须在多个方面不断发展。荧光染料的可得性是主要限制因素。只有少数多克隆抗体可供选择,且不同批次抗体的结果差异以及交叉反应,这些状况带来了额外的挑战。幸运的是,随着新型杂交瘤技术的引入,Kohler和Milstein在将产生抗体的B细胞与永生骨髓瘤细胞融合以产生特异性抗体方面取得了技术突破5。由此产生的单克隆抗体及其对生物标志物特异性表位的高度特异性和可再现、可靠的检测,为将其应用于其他领域带来了巨大希望。Herzenberg将使用杂交瘤技术产生的单克隆抗体用于FACS6,证明了该组合具有巨大潜力,使FACS成为一种强大的细胞分析技术。为此,单克隆抗体必须投入商业生产。
碧迪医疗单克隆中心的成立以及流式细胞术试剂和仪器的发展
斯坦福大学Len Herzenberg与碧迪医疗生物科学 Bernie Shoor继续合作,成立了碧迪医疗单克隆中心,可确保基于FACS的研究所需可靠试剂的稳定供应。70年代初,荧光素和罗丹明是仅有的两种可用于标记生物标志物的荧光染料(参见流式细胞术染料发展时间线)。引入紫外线、紫光和蓝光范围内的额外激光源后,可对细胞周期所涉及的标志物进行分析且可进行染色体分析。氦氖激光使藻类和蓝藻衍生的分子能够吸收光能并转移至荧光分子(如藻红蛋白[PE]和别藻蓝蛋白[APC]),从而在FACS中得到有效利用。7 PE与其他染料一起使用的能力为复杂细胞群的高参数流式细胞术分析开辟了一个全新的世界。
1985年,碧迪医疗生物科学推出了BD FACScan™ 流式细胞仪,这是首款能够同时测量三种颜色的商用仪器。通过使用该仪器,可从五个不同的维度(包括与大小、形状和复杂性等物理特征相关的两个散射参数)对细胞进行评价。此外,该仪器也是首款采用石英液槽固定对准而无需仪器操作员每日手动调整激光的仪器。首款四色流式细胞仪——BD FACScan™ 流式细胞仪经过十年的发展,可测量的参数数量从3个变为10个,能够同时分析免疫细胞群的功能和表型,例如,通过特异性鉴定的免疫细胞亚群对细胞因子进行细胞内定量。
除了增加可测量参数的数量,另一个必须解决的问题是流式细胞仪的庞大尺寸及其维护。为了使装置微型化,1995年推出了BD FACSCalibur™ 流式细胞仪,它是一种更紧凑的台式仪器,能够进行分析和细胞分选,为研究者腾出了更多的实验室空间。该仪器还包括用于自动化的BD FACS™ 加样工作站和BD®高通量进样器等选件以及用于运行各种应用程序的专用软件。
引入二极管红色激光线后,可使用华青染料进行免疫标记,并开发出了PE-Texas Red、PE-Cy5、PE-Cy5.5和PE-Cy7等串联染料。8使用这些染料阵列构建了一个8色、10参数流式细胞术panel,用于说明白细胞的异质性9。20世纪90年代,基于APC的串联染料和小型有机染料以及基于半导体纳米晶体的染料也开始投入商业应用,实现了多达18色的流式细胞术。8
除了目前能够同时评价更多的表面标志物以外,所有这些新型荧光染料的可得性还对新试剂和检测方法的开发产生了直接影响,如BD Phosflow™ 试剂和基于微球的免疫测定(称为BD
®细胞计量微球阵列[CBA])。通过分别鉴定细胞内磷酸化标志物和量化分泌的细胞因子,可以使用这些检测方法更好地了解细胞的功能。
尽管这些染料种类繁多,但它们有效吸收光线的能力大多有限,从而影响了测定的灵敏度。通过使用2000年获得诺贝尔奖的导电聚合物化学解决了该问题10。Sirigen将一类独特的导电聚合物用作分子天线,开发出了新的聚合物染料,使染料亮度有了新的变化。2014年,碧迪医疗生物科学收购了Sirigen,并采用该技术开发出了BD Horizon Brilliant™ Violet和Ultraviolet染料,其更明亮的染料选择改变了免疫表型的现状。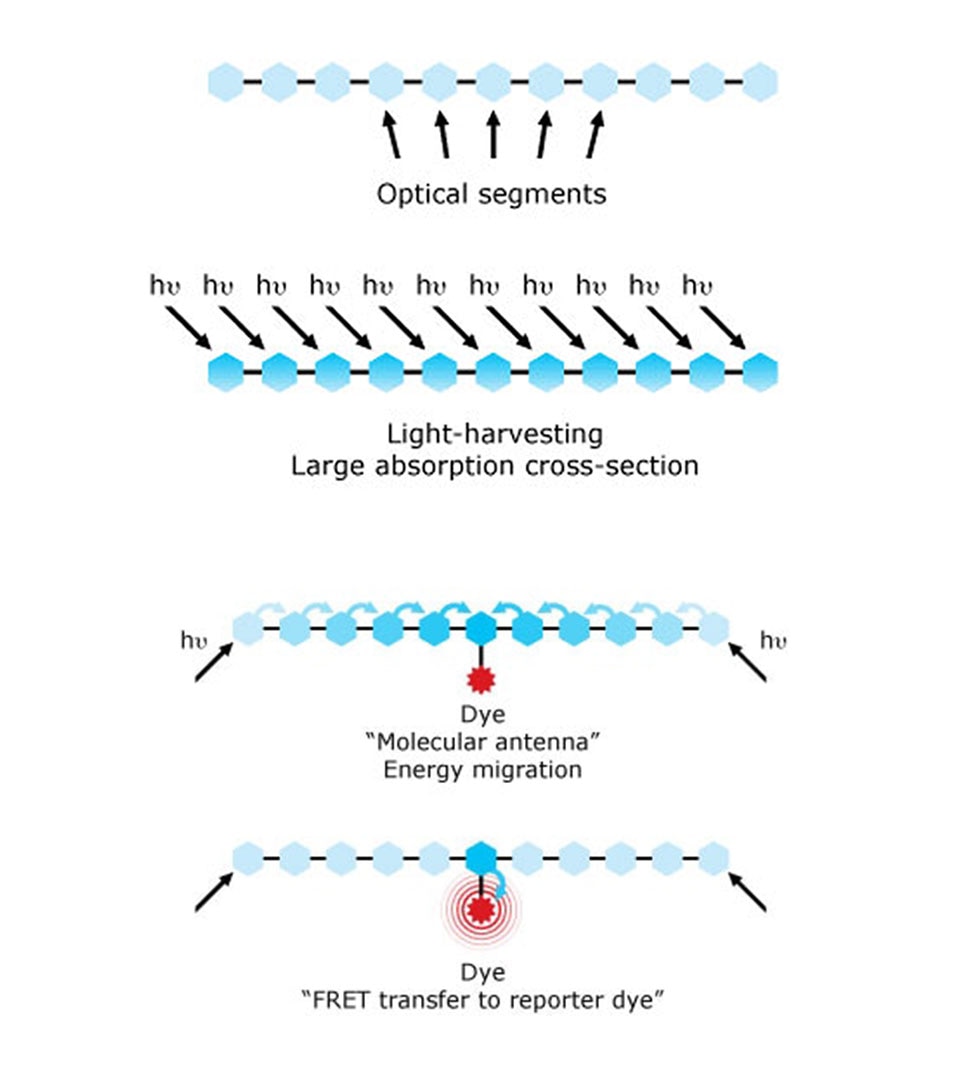
与此同时,仪器功能也在飞速发展。本世纪前十年,碧迪医疗推出了多款细胞分析仪和分选仪。有趣的是,其中一台仪器——BD FACSVantage™ 流式细胞仪已被转移到马萨诸塞州综合医院Paul S. Russell,MD医学历史与创新博物馆,用于器官移植的前沿研究。2008年首款7激光特殊可定制化(根据用户的特定研究需求进行配置的)BD® LSR II流式细胞仪为许多科学发现做出了贡献。另一款定制仪器——BD LSRFortessa™ X-20细胞分析仪与BD Horizon Brilliant™ Violet染料和BD FACSDiva™ 软件兼容,可同时分析20个参数。除更高参数的细胞分析仪以外,碧迪医疗还推出了简化的台式细胞分选仪,如BD FACSAria™ 细胞分选仪。这是首项将电磁液滴分选与固定对准激光器结合到凝胶耦合液槽流动室中的技术,可提供与细胞分析仪类似的性能和体验,同时还通过BD FACS™ Accudrop和Sweet Spot技术为分选工作流程引入了变革性自动化,使研究者更易于进行细胞分选。
21世纪10年代,碧迪医疗生物科学继续通过创新推动了仪器的发展。通过实施自动化过程,台式分选仪扩展了细胞分选的能力,同时仍可方便研究者使用。这一成就推动了尺寸更小、自动化程度更高的仪器的全面发展,包括BD FACSVerse™ 流式细胞仪和BD FACSMelody™ 细胞分选仪。
与此同时,方法标准化、消除实验室之间和实验室内部手动过程和工作流程不一致对于对再现性和可靠性要求极高的临床实验室至关重要,这推动了具有这些功能的临床流式细胞仪的发展。支持更加标准化过程的自动化技术的引入推动了对新一代临床流式细胞仪的需求,如与FACSDuet™ Premium样品制备系统集成的BD FACSLyric™ 流式细胞仪,该仪器可提供临床实验室所需的工作流程效率和结果。分析仪和分选仪的成对发展与紫外激光激发的新型荧光染料(BD Horizon Brilliant™ Ultraviolet染料)的发展相一致,在该背景下还推出了高参数仪器新系列,用于支持包括免疫学和免疫肿瘤学在内的各个领域的多色实验。BD FACSymphony™ A3和A5细胞分析仪以及BD FACSymphony™ S6细胞分选仪提供了生成30参数流式细胞术数据的功能,甚至超过了使用过滤后的单个PMT检测器评价特异性荧光染料和应用传统补偿工作流程的常规方法。
流式细胞术软件的发展
流式细胞术发展过程中的另一个限制因素是需要更智能的软件来分析所有多参数流式细胞术数据。常规的流式细胞术数据分析需要对区域进行手动权门,且需要分析不同参数组合。在仅需测量几个参数的最初阶段,进行该操作非常简单,使用简单的二维图即可完成。但随着荧光染料数量的增加,可测量参数的数量也随之增加,二维图的数量也呈指数式增加,使数据分析变得异常复杂。20世纪70年代引入FACS后的最初15年中,现有软件的局限性阻碍了可测量参数数量的增加。
通常情况下,流式细胞仪均配备有仪器专用软件,如2002年推出的BD FACSDiva™ 软件,目前可支持十台碧迪医疗流式细胞仪!除了仪器中嵌入的软件以外,20世纪90年代还推出了独立软件,如FlowJo™ 软件。该软件提供的分析功能和选件可增加流式细胞术数据分析的灵活性和功能,从而支持其不断进步,可提供更多的数据参数,且可对每个细胞进行更多维度的分析。多年来,FlowJo™ 软件不断发展,与仪器的发展速度如出一辙。经过近三十年的发展和10个主要版本的更新,与仪器无关的FlowJo™ 软件已能够支持新一代流式细胞仪所生成文件的不断变化,同时可提供更新的数据分析、解释、可视化和显示方法。目前,该软件处于将tSNE和UMAP等降维方法融入流式细胞术领域的前沿,以此支持最新技术引入的高参数数据,使研究者能够以前所未有的速度找到答案。
光谱流式细胞术的问世
在过去几十年中,使用光谱流式细胞术进行细胞分析的另一种方法逐渐得到推广。光谱流式细胞术于2004年在国际分析细胞学学会大会上首次推出11,此后不断发展。常规的流式细胞仪仅收集由每种荧光染料的单个滤光片和检测器定义的发射光谱的离散部分,而光谱流式细胞仪则收集间隙极小的整个可见光谱。每种荧光染料的发射光谱均由经过过滤的检测器阵列收集。使用光谱解混算法来确定单个荧光染料的贡献,使其有别于常规流式细胞仪上用于补偿的传统算法。碧迪医疗于2021年推出了支持光谱的FACSymphony™ A5 SE细胞分析仪,该仪器能够实现可见全光谱覆盖,且可进行40多种颜色测量(多达50个参数),从而实现常规流式细胞术和光谱流式细胞术。同时开发出的支持光谱的荧光染料(如BD Horizon RealYellow™ 和BD Horizon RealBlue™ 染料)设计用于减少溢漏,提高了使用光谱流式细胞术进行细胞分析的能力。由此,碧迪医疗于2023年推出了用于光谱分析的最新技术。BD FACSDiscover™ S8细胞分选仪中的BD SpectralFX™ 技术通过78个荧光APD检测器和经过算法优化的滤光片带宽,可实现全光谱细胞分析和分选。
成像流式细胞术
多参数数据分析可根据二维等高线图上圈门区域内的荧光信号强度得出重要见解。然而,该方法缺乏单细胞成像所能获得的空间分辨率,而且容易产生错误结果,无法区分双联体、碎片和真正的单细胞。此外,无法通过该技术轻松测量蛋白质生物标志物在细胞内的位置。成像流式细胞术解决了其中的一些问题;它将流式细胞术与成像技术相结合,可进行单细胞成像,但无法与高速分选技术相结合。数十年来,细胞实时成像与高速、高通量分选的结合始终是一个尚未实现的梦想。
2022年,碧迪医疗生物科学推出了开创性的BD CellView™ 图像技术,可进行超快速细胞成像和高速细胞分选,从而将这一梦想变为现实。该产品采用无线通信行业的技术实时获取多色荧光图像,并利用这些信息以每秒15,000次的速度进行细胞分选!12
2023年,通过将该技术与可实现全光谱细胞分选的BD SpectralFX™ 技术相结合,创造出了首款实时成像光谱细胞分选仪:BD FACSDiscover™ S8细胞分选仪。光谱流式细胞术与实时空间和形态学信息(RTI-SFC)的结合以及全新的模块化光学架构和系统感知算法为科学家提供了无限可能性。
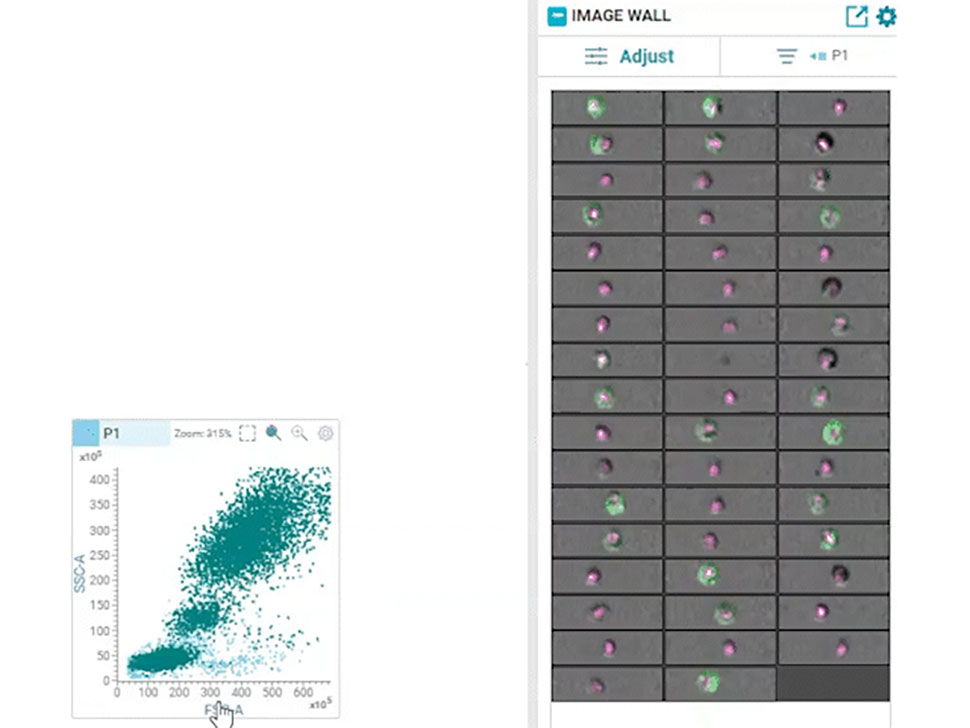
从20世纪70年代引入FACS到如今的50多年间,人们已经认识到FACS在多参数高维分析中用于辨别、列举和分选免疫细胞亚群的惊人能力,其在临床环境中得到广泛应用。最先从中受益的领域之一是免疫缺陷病毒(HIV)研究。20世纪80年代,在艾滋病爆发的高峰期,FACS用于临床诊断,随后用于HIV的评价和监测。流式细胞术有助于确定CD4+细胞的耗竭是否是HIV感染的标志性表现。13用于测量CD4+辅助性细胞和CD8+细胞毒性细胞的三色流式细胞术推动了该技术的临床应用。随后的大量研究采用流式细胞术来鉴定活化T细胞、早期T细胞、调节性T细胞和T细胞功能的标志物14。因此,临床流式细胞术首次用于HIV患者的管理不足为奇。在随后数年里,除了HIV,关于白血病和淋巴瘤的研究也受益于流式细胞术的使用。近年来,对细胞外囊泡等小颗粒作为生物标志物的潜在用途进行了广泛研究,小颗粒检测仪器(如BD FACSymphony™ A1流式细胞仪)的发展正在帮助科学家突破这一领域的研究界限。15,16
在过去数十年里,癌症免疫疗法这一新兴领域从实验室走向了临床,前者在揭示免疫检查点抑制背后的生物学原理方面取得了快速进展。建立了癌症治疗的一种新模式,即利用靶向抑制通路的方法来阻断对癌症的有效免疫反应。流式细胞术在说明细胞毒性T淋巴细胞相关抗原4(CTLA-4)蛋白和免疫抑制受体PD-1阻断对提供抗肿瘤免疫的作用方面发挥了重要作用。17,18,19 James Allison和Tasuku Honjo均为开发出这些策略的科学人士,二人在2018年获得了诺贝尔生理学和医学奖。碧迪医疗生物科学很荣幸曾参与其策略开发,能够为其具有里程碑意义的实验提供多台碧迪医疗流式细胞仪,如BD FACScan™、BD® LSR II和BD FACSCalibur™。
尽管取得了上述所有进展,但这只是我们了解流式细胞术应用前景的冰山一角。FACSDiscover™ S8细胞分选仪中实时成像与光谱流式细胞术的结合为可测量的信息带来了无限可能。流式细胞术的前景依然不可限量!
