Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

T Cells
T 림프구는 병원균의 제거, 면역 요법에서의 적용 및 다양한 질병과의 조절 장애와의 연관성에 대한 우리의 역할에 대한 이해가 높아지면서 지난 10 년 동안 많은 연구의 대상이 되었습니다. 인간면역결핍바이러스(HIV) 등 감염에 의해 매개되는 T세포의 고갈과 후천성면역결핍증후군(AIDS)1 등 심각한 2차면역결핍증후군(AIDS)이 대표적입니다. 건강한 사람의 경우 mature T cells 및 T regulatory cells (Tregs)는 말초 면역 내성을 유지하여 자가 항원에 대한 자가 면역을 방지합니다. 최근 관심의 대상은 PD-1 및 CTLA-4와 같은 T cell 수용체를 대상으로 하는 면역 체크 포인트 억제제로, 이는 종양 미세 환경에서 T cell activation과 antigen-experienced T cells의 증식을 억제하지 않는데 성공했습니다. 이 전략은 흑색종 및 기타 종양에 대한 치료에 성공적으로 사용되었습니다. 항 CD19 CAR-T 세포와 같은 2 개의 키메라 항원 수용체 (CAR) -T 세포는 급성림프구성 백혈병 등 B cell 악성 종양에 대해 매우 성공적 (약 93 % 반응)을 보였습니다.2 유세포 분석은 면역 표현형 분석 및 T 세포 분석을 위한 강력한 도구를 제공하여 이러한 각 분야에 대한 통찰력을 향상시킵니다.
T Cell의 기원과 발달
T cell은 골수에서 시작되어 성숙을 위해 흉선으로 이동합니다. T cell의 특징적인 마커는 T 세포 수용체 (TCR)와 TCR 복합체의 구성원인 CD3입니다. 이들은 다른 표면 분자 인 CD4 (CD4 + 또는 helper T cell) 및 CD8 (CD8 + 또는 cytotoxic T cell)의 발현에 의해 두 가지 predominant type으로 분류할 수 있습니다. 3
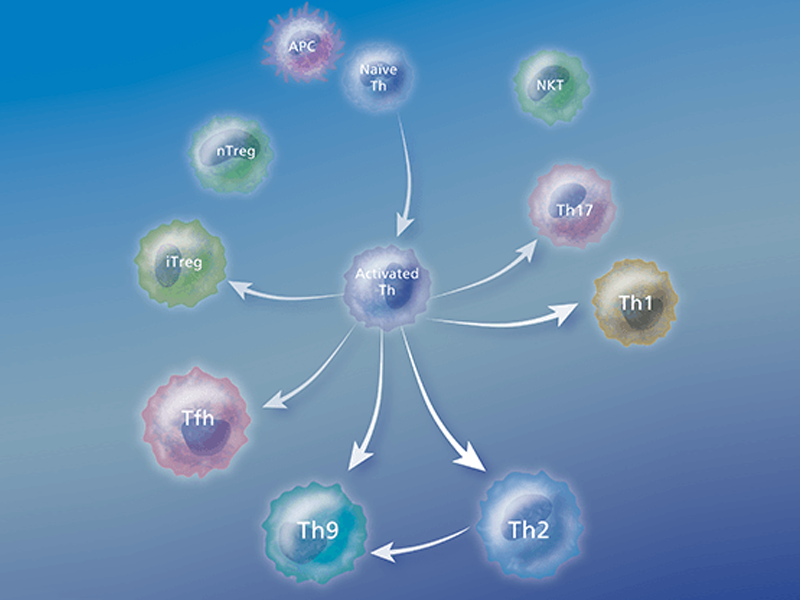
T 세포의 유형
Helper T cells
Helper T (Th) cell은 적응 면역 반응과 염증성 질환의 필수 조절자입니다. 림프구의 하위 그룹인 Helper T cell은 면역 체계의 기능을 확립하고 최대화하는데 중요한 역할을 합니다. 이 세포는 세포 용해 또는 식세포 활동이 거의 또는 전혀 없다는 점에서 특이합니다. 그러나 그들은 다른 면역 세포를 활성화하고 지시하는데 관여합니다.
수지상 세포, 대식세포 및 B cell와 같은 전문 항원 제시 세포 (APC)에 의해 활성화된 후 항원 특이적 CD4 + T cell은 세포막에서 발현하거나 분비하는 cytokine 및 effector molecules 측면에서 특화된 effector cell 분화합니다. 몇 가지 유형의 Th 세포가 밝혀졌습니다.
Th1 cells
Th1 세포는 세포 면역 반응과 세포내 병원체에 대한 숙주 방어에 관여합니다. 이 분자들은 IFN-γ, IL-2 및 림프 독소 -α (LTα)와 같은 pro-inflammatory cytokine의 생성을 특징으로 합니다. Th1 세포는 세포 매개 면역에 중점적으로 관여합니다. Th1 세포에 의해 생성된 cytokine은 대식세포 및 기타 림프구에 의한 미생물 병원체의 식균 작용과 파괴를 자극합니다. 다발성 경화증, 당뇨병 및 류마티스 관절염 등 여러 만성 염증성 질환이 Th1 우성 질환으로 설명되었습니다.
Th2 cells
Th2 세포는 체액성 면역 반응과 세포 외 기생충에 대한 숙주 방어에 관여합니다. 이 세포들은 IL-4, IL-5, IL-6, IL-10 및 IL-13의 생산을 특징으로 합니다. Th2 세포는 알레르기 반응에서 역할을 하는 것으로 알려져 있습니다. IL-4와 같은 cytokine은 일반적으로 큰 세포 외 기생충에 대한 항체 생산을 자극하는 반면, IL-5는 큰 세포 외 기생충에 대한 호산구 반응을 자극합니다. 알레르기와 아토피는 Th2-dominant 상태에서 발생합니다. 오랜 기간Th2 세포는IL-9의 원천으로 여겨져 왔습니다. 그러나 최근 학술 논문에서는 IL-9 및 IL-10의 분비를 특징으로 하는 Th2 관련 세포 유형의 존재를 시사하고 있습니다. 이러한 소위 Th9 세포는 TGF-β의 존재 하에 Th2 세포로 분화할 수 있거나 IL-4와 TGF-β의 조합이 있는 naive CD4 세포로 분화할 수 있습니다. 이 세포는 천식 및 조직 염증에 관여할 수 있습니다.
Th1과 Th2 cell의 균형
Th1 cell이 IFN-γ를 생산할 때 대식세포가 TNF와 독성 형태의 산소를 생성하도록 촉진하여 phagosome과 lysosome 내의 미생물을 파괴합니다. 반면, Th2 cell이 IL-4와 IL-10을 생산할 때, 이러한 cytokine은 IFN-γ에 의해 활성화되는 미생물 사멸을 차단합니다. 이식과 관련하여 Th1/Th2 관계도 연구되었습니다. Th1 반응은 대부분의 형태의 급성 이식 또는 이식 거부 및 graft-versus-host (GVHD) 질환과 관련이 있는 반면, Th2 반응은 보호 또는 만성 거부와 다양하게 연관되어 있습니다. 그러나 복제된 Th1 또는 Th2 cell은 실험 모델에서 피부 이식을 거부하는 유사한 능력을 가지고 있으며, Tr1/Treg cell은 현재 보호 및 내성 유도에 관여하고 있습니다. 태아는 또한 동종 이식과 유사하며 Th2 또는 Treg 반응은 보호하는 것으로 생각되며 Th1은 재흡수 또는 자연 유산으로 이어질 수 있습니다 4.
Th17 cells
Th17 cell은 cell 외 병원체에 대한 염증 및 숙주 방어에 관여합니다. IL-17A를 생산하는 helper T cell의 subset인 Th17 cell은 자가 면역 조직 손상의 유도에 중요한 역할을 하는 것으로 나타났습니다. 그들은 IFN-γ 또는 IL-4와 같은classical Th1 또는 Th2 cytokine을 생산하지 않기 때문에 Th1 또는 Th2 cell과 구별됩니다. 이들은 autoimmunity의 mouse model에서 핵심적인 역할을 하며, naive helper T cell에서Th17 세포로의 분화 경로는 TGF-β와 IL-6의 조합을 포함한다고 제안되었습니다. RORγt는 Th17 cell의 유도에 관여하는 주요 전사 인자입니다. 일부 RORγt 발현은 IL-6 또는 TGF-β에 대한 반응으로 유도되지만 Th17 cell의 생성에는 IL-6뿐만 아니라 TGF-β가 필요합니다.
또한, 정상 상태에서 IL-6 및 TGF-β의 상대적 균형은 다양한 조직에서 Th17 또는 Treg 분화에 유리하게 균형을 기울일 것으로 생각됩니다. Th17 subset 유도는 TGF-β와 IL-6을 필요로 하는 반면, IL-17A–producing cell의 증폭은 TGF-β와 IL-21에 의존합니다. Th17 반응의 유지는 주로 IL-23 (p19 / p40)에 의존합니다. IL-23은 STAT3의 downstream activation 과 후속 ROR-γ의 upregulation 및 IL-17A의 생산을 유발하는 IL-23 수용체에 결합합니다.
IL-17A는 TNF, IL-6 및 IL-1β와 같은 많은 pro-inflammatory factor생성을 유도하기 때문에 Th17 세포가 뇌척수염 및 대장염과 같은 실험적 자가면역 질환의 발달 및/또는 진행과의 관련성이 언급되었습니다.
Regulatory T cells
Regulatory T cells (Tregs)는 면역 항상성을 유지하는데 중요한 역할을 합니다.2 Treg는 다른 T cell의 기능을 억제하여 면역 반응을 제한합니다. Tregs의 수와 기능의 변화는 다발성 경화증, 활동성 류마티스 관절염 및 제1 형 당뇨병을 포함한 여러 자가 면역 질환과 관련이 있습니다. 폐암, 췌장암 및 유방암을 포함한 많은 악성 질환에서 높은 수준의 Tregs이 발견되었습니다. Tregs는 또한 antitumor immune response를 막아5 사망률을 증가시킵니다.
Regulatory T cells (Tregs)의 면역 억제 잠재력에 대한 발표된 여러 데이터가 축적됨에 따라 잠재적인 적용에 대한 관심이 높아졌습니다. 따라서 Treg 연구는 매우 활발하게 진행되며 이와 관련한 간행물도 자주 발행됩니다. 오늘날 Treg 식별, 분리 및 특성화에 일반적으로 사용되는 markers는 CD4, CD25, CD127 및 FoxP3입니다. 그러나 CD39, CD45RA, CTLA-4 등과 같이 기능적으로 중요한 새로운 표적이 빠르게 등장하고 있습니다.
CD4 및 CD8 T reg
현재까지 두 가지 주요 Tregs class가 확인되었습니다: CD4 및 CD8 Tregs. CD4 Tregs는 CD25와 FoxP3를 구성적으로 표현하는 Natural Tregs (nTregs)와 소위 적응 또는 유도 (iTregs)의 두 가지 유형으로 구성됩니다.
Natural Tregs는 전사인자 (및 계보 marker) FoxP3와 함께 높은 수준의 CD25를 발현하는 CD4 + cell로 thymus (흉선)에서 유래합니다. nTreg는 전체 CD4 + T cell population의 약 5-10 %를 차지하며 T lymphocyte 발달의 single-positive stage에서 처음 볼 수 있습니다.6, 7 이들은 self-antigen에 대해 상대적으로 높은 결합력을 가진 thymocyte입니다. Treg cell로 발전하는 신호는 T cell receptor 와 thymic stroma(흉선 기질)에서 발현되는 self-peptide와 MHC II의 복합체 사이의 상호 작용에서 오는 것으로 생각됩니다.5 nTreg은 본질적으로 cytokine independent 특성을 갖고 있습니다.
적응성 또는 유도성 Treg는 single-positive CD4 세포로서 thymus (흉선)에서 유래합니다. 동족 항원과 TGF-β, IL-10 및 IL-4.8과 같은 특수한 면역 조절 cytokine의 존재 하에 적절한 항원 자극 후 Treg (iTregs)를 발현하는 CD25 및 FoxP3로 분화됩니다8.
FoxP3는 현재 Tregs9에 대해 가장 많이 사용되는 marker이며, FoxP3-Treg의 small population에 대한 보고가 있었습니다. Tregs의 마커로서 전사 인자 FoxP3의 발견으로 과학자들은 Treg 집단을 더 잘 정의하여 CD127을 포함한 추가 Treg marker를 발견할 수 있었습니다10.
CD127 Cells
CD127은 CD127과 다른 cytokine receptor (IL-2R, IL-4R, IL-9R, IL-15R 및 IL-21R)에 의해 공유되는 common gamma chain 으로 구성된 heterodimeric IL-7 수용체의 일부입니다. CD127은 thymocyte, T 및 B cell progenitor, mature T cell, monocyte 및 일부 다른 lymphoid 및 myeloid cell에서 발현됩니다. 연구에 따르면 IL-7R은 mature T cell 증식 및 분화에 중요한 역할을 하며, 시험관 내 실험에서는 T cell activation 후 CD127의 발현이 downregulation되는 것으로 나타났습니다.11 FoxP3은 CD127 promoter 와 상호 작용하고 Tregs에서 CD127의 expression 감소에 기여할 수 있습니다.
참고문헌
- McCune JM. The dynamics of CD4+ T-cell depletion in HIV disease. Nature. 2001;410(6831):974-979. doi: 10.1038/35073648
- Todryk S, Jozwik A, de Hayilland J, Hester J. Emerging cellular therapies: T cells and beyond. Cells. 2019;8:284. doi:10.3390/cells8030284
- Mousset CM, Hobo W, Woestenenk R, Preijers F, Dolstra H, van der Waart AB. Comprehensive phenotyping of T cells using flow cytometry. Cytometry A. 2019;95(6):647-654. doi:10.1002/cyto.a.23724
- Qian J, Zhang N, Lin J, et al. Distinct pattern of Th17/Treg cells in pregnant women with a history of unexplained recurrent spontaneous abortion. Biosci Trends. 2018;12(2):157-167. doi:10.5582/bst.2018.01012
- Overacre-Delgoffe AE, Chikina M, Dadey RE, et al. Interferon-γ drives Treg fragility to promote anti-tumor immunity. Cell. 2017;169(6):1130-1141.e11. doi:10.1016/j.cell.2017.05.005
- Workman CJ, Szymczak-Workman AL, Collison LW, Pillai MR, Vignali DA. The development and function of regulatory T cells. Cell Mol Life Sci. 2009;66(16):2603-2622. doi:10.1007/s00018-009-0026-2
- Schiavon V, Duchez S, Branchtein M, et al. Microenvironment tailors nTreg structure and function. Proc Natl Acad Sci U S A. 2019;116(13):6298-6307. doi:10.1073/pnas.1812471116
- Liu M, Li S, Li MO. TGF-β control of adaptive immune tolerance: a break from Treg cells. Bioessays. 2018;40(11):e1800063. doi:10.1002/bies.201800063
- Lu L, Barbi J, Pan F. The regulation of immune tolerance by FOXP3. Nat Rev Immunol. 2017;17(11):703-717. doi:10.1038/nri.2017.75
- Rodríguez-Perea AL, Arcia ED, Rueda CM, Velilla PA. Phenotypical characterization of regulatory T cells in
humans and rodents. Clin Exp Immunol. 2016;185(3):281-291. doi:10.1111/cei.12804
- Di Caro V, D'Anneo A, Phillips B, et al. Interleukin-7 matures suppressive CD127(+) forkhead box P3(FoxP3)
(+) T cells into CD127(-) CD25(high) FoxP3(+) regulatory T cells. Clin Exp Immunol. 2011;165(1):60-76.
doi: 10.1111/j.1365-2249.2011.04334.x
BD Biosciences는 T cell 연구를 위한 포괄적인 시약 및 키트 포트폴리오를 제공합니다.
T cell을 연구하는데 사용되는 방법 중 multicolor 유세포 분석은 기능적으로나 표현형적으로 매우 복잡한 T cell subsets의 특성 분석을 가능하게 합니다. ELISA, ELISPOT 및 bead-based immunoassay과 같은 보완 기술은 T cell 영역에 대한 추가 연구를 통해 다양한 실험 요구 사항을 충족할 수 있는 유연성과 결과를 확인하는 여러 방법을 제공합니다.
다음 표는 T cell 연구를 지원하고 실험 요구 사항을 충족하는 것을 찾는데 도움이 되는 도구 및 기술의 중요한 특성을 나열합니다. 특정 기술은 sample에 대한 특정 정보를 공개하거나 사용 가능한 장비 또는 sample 유형과 같은 실제 요구 사항을 더 잘 충족할 수 있습니다. 경우에 따라 연구자들은 여러 기술의 결합된 정보를 사용하여 결과를 확인할 수 있습니다. 다른 접근법은 T cell 발달에 기여하는 메커니즘의 상세한 그림을 그릴 수 있도록 합니다.
| Tool/Technology | Flow Cytometry: Surface | Flow Cytometry: Introcellular | BD™ Cytometric Bead Array (CBA) | ELISPOT | ELISA | In Vivo Capture Assay |
|---|---|---|---|---|---|---|
| Molecules detected | Surface | Intracellular and surface | Secreted or intracellular | Secreted (in situ) | Secreted | Secreted (in vivo) |
| Multiparameter | Yes | Yes | Yes | No | No | No |
| Single cell/cell subset information | Yes | Yes | No | Frequencies, no subset information | No | No |
| Antigen-specific | Yes | Yes | Yes | Yes | Yes | Yes |
| Post-assay viability | Yes | No | Yes, for secreted molecules | No | Yes | Yes |
| Quantitation of protein | Possible* | Possible* | Yes | No | Yes | Yes |
| Instrumentation | Flow cytometer | Flow cytometer | Flow cytometer | ELISPOT reader | Spectrophotometer | Spectrophotometer |
*With a standard such as BD Quantibrite™ beads
Immunophenotyping: surface 및 intracellular marker 결합
UMulticolor 유세포 분석을 사용하고 표면 표현형을 cytokines, transcription factor 또는 signaling molecule의 intracellular staining 과 결합하여 특성 marker signature를 기반으로 개별 T cell subset을 식별할 수 있습니다. BD 고급 시약 시스템, 광범위한 marker 선택 및 풍부한 지원 도구는 연구원이 phenotyping을 단순화하고 개별 sample에서 얻은 정보를 최대화하는 데 도움이 됩니다. .
유용한 연구 도구인 유세포 분석법에 의한 Immunophenotyping 분석은 세포 marker의 differential expression (차등 발현)을 사용하여 T cell과 그 subset을 분리하고 특성화 합니다. T cell 및 이들의 subset는 CD3, CD4, CD8 및 CD25를 포함하는 세포 표면 marker의 differential expression에 의해 정의될 수 있습니다. 이러한 특정 marker에 직접 접합된 fluorescent antibodies panel을 사용하는 multicolor 유세포 분석을 통해 연구원은 개별 cell에서 여러 marker의 수준을 동시에 조사할 수 있습니다. 이는 특정 샘플에서 cell 계통 및 cell subset의 분화 상태에 대한 정보를 제공할 수 있습니다. 분석에 CCR7, CD62L 또는 CD69와 같은 marker를 추가하면 관심있는 T cell subset의 활성화 상태 뿐만 아니라 세포가 체내에 집으로 돌아와 위치할 수 있는 가능성에 대한 중요한 정보를 얻을 수 있습니다. 연구자들은 cell surface receptor 뿐만 아니라 cytokine 분비profiles 및 intracellular signaling molecule을 포함한 다양한 marker의 발현 패턴을 분석하여 기능적으로 구별되는 T cell subset (예 : Th1, Th2, Th17, Treg, Th9)을 나타내는 표현형을 정의했습니다.
Major Known T Cell Markers
| Type of Cell | Cytotoxic | Th1 | Th2 | Th91 | Th17 | Tfh2 | Treg |
|---|---|---|---|---|---|---|---|
| Main Function | Kill virus-infected cells | Activate microbicidal function of infected macrophages and help B cells to produce antiboday | Help B cells and switch antibody isotope production | T cell proliferation and enhance IgG and IgE production by B cells | Enhance neutrophil response | Regulate development of antigen specific B cell development and antibody production | Immune regulation |
| Pathogens Targeted | Viruses and some | Inracelluar pathogens | Parasites | Parasites | Fungi and extracellular bacteria | ||
| Extracellular Markers | CD8 | CD4, CXCR3 | CD4, CCR4, Cith2 (human) | CD4 | CD4, CCR6 | CD4, CXCR5 | CD4, CD25 |
| Differentiation Cytokines | IFN-y, IL-2, IL-12, IL-18, IL-27 | IL-4, IL-2, IL-33 | IL-4, TGF-β | TGF-β, IL-6, IL-1, IL-21, IL-23 | IL-12, IL-6 | TGF-β, IL-12 | |
| Effector Cytokines | IFN-y, TNF, LT-α | IFN-y, LT-α, TNF | IL-4, IL-5, IL-6, IL-13 | IL-9, IL-10 | IL-17A, IL-17F, IL-21, IL-22, IL-26, TNF, CCL20 | IL-21 | TGF-β, IL-10 |
| Transcription Factors | T-bet, Stat1, Stat6 | GATA3, Stat5, Stat6 | GATA3, Smads, Stat6 | RORyet, RORα, Stat3 | Bci-6, MAF | FoxP3, Smad3, Stat5 |
Markers can be altered as a result of cellular environment, differentiation state, and other factors. Key cytokine appear in bold. BD Biosciences offers reagents for molecules that are green.
- Soroosh P. Doherty TA. Th9 and allergic disease. Immunology. 2009; 127:450-458.
- Fazilleau N, Mark L, McHeyzer-Williams LJ, McHeyzer-Williams MG. Follicular helper T cells: lineage and location. Immunity. 2009:30:324-355
CD4 + T cell subset를 측정하기 위한 multicolor유세포 분석 panel자세히 설명하는 panel sheet를 참조하십시오.
cell sorting 에 의한 선택된 cell populations 의 분리
정의된 cell population은 BD FACSAria™ III, BD FACSMelody™ 및 BD FACSymphony™ S6 유세포 분석 시스템과 같은 surface marker 및 cell sorter의 특정 조합을 사용하여 복잡한 cell mixture에서 분리할 수 있습니다. 정제된 viable cell population은 배양에서 확장, 분화 및 유지될 수 있습니다. 특정 응용 분야의 경우 BD Biosciences 과학자들은 CD4가 풍부한 cell을 사용하여 human Treg 세포를 분리하고 CD4 + CD25 int-hiCD127 낮은 phenotype에서 분류하는 방법과 같은 분류를 위한 상세한 protocol을 개발하여 효율성을 높이고 yield (수율)를 높였습니다.
T cell subset-specific response 분석을 위한 Intracellular cytokine 측정
Multicolor 유세포 분석을 사용하여 intracellular cytokine을 측정하는 것은 mixed cell population 내의 반응 스펙트럼에 대한 통찰력을 얻을 수 있는 강력한 도구입니다. 하나의 분석에서 여러 cytokine 과 cell surface marker를 동시에 측정함으로써 subset이 어떤 cytokine을 생성하는지에 대한 통찰력을 제공합니다. 예를 들어, multicolor유세포 분석은 특정 cytokine signature를 기반으로 Th1, Th2 또는 Th17 cell을 식별하는데 사용할 수 있습니다. cell-by-cell 분석을 통해 연구원은 distinct cell subset의 반응을 물리적으로 분리하지 않고도 분석할 수 있습니다.
Intracellular cytokine 측정 시스템
Intracellular protein 측정을 위해서는 fluorescent antibody가 target protein에 들어가서 측정할 수 있도록 세포를 고정하고 투과화해야 합니다. 다른 항원은 고정 및 투과성에 대한 민감도와 요구 사항이 다르므로 protocol의 추가 최적화가 수반됩니다. 분비된 단백질인 cytokine을 측정하기 위해서는 protein transport inhibitor가 세포 내부에 단백질을 가두어야 합니다. BD Biosciences는 intracellular cytokine 측정을 위해 널리 사용되는 두 가지 분석 시스템 인 BD Cytofix / Cytoperm ™ Reagents 및 BD FastImmune ™ Cytokine System을 제공합니다. 두 시스템 모두 연구자가 테스트된 시약 및 protocol을 쉽고 자신있게 사용할 수 있도록 하며 BD 유세포 분석 제품으로 알려진 높은 수준의 품질과 재현성을 통합합니다. BD Phosflow ™ Reagents는 multicolor 유세포 분석을 사용하여 T cell 신호와 관련된 phosphorylated protein 수준을 안정적으로 측정하고 데이터를 subset 식별과 결합하는데 도움이 됩니다.
BD Cytofix / Cytoperm ™ Reagent 방법
BD Cytofix / Cytoperm ™ Reagent 방법 및 관련 시약은 기본 연구의 광범위한 실험 요구를 해결합니다. 광범위한 cytokine 및 여러 종을 위한 제품으로 BD Cytofix / Cytoperm ™ Reagents는 세포 내 cytokine 염색에 최대한의 유연성을 제공합니다. BD Biosciences는 세포내 유세포 분석을 통해 intracellular cytokine 측정을 위한 여러 솔루션을 제공합니다.
BD FastImmune™ System
BD FastImmune ™ System은 human sample에 대한 응용 연구의 요구 사항을 충족하도록 설계되었습니다. 완전한 시스템에 초점을 맞춘 이 접근 방식은 질병 중 면역 상태를 모니터링하거나 백신 후보에 대한 면역 반응을 모니터링하는 연구에 적합합니다. BD FastImmune ™ CD4 intracellular cytokine 측정 키트 Anti-Hu-TNF-α / CD69 / CD4 / CD3은 전혈의 항원 활성화 CD4 + T lymphocyte에서 세포 내 cytokine및 활성화 marker CD69를 측정하도록 설계되었습니다. 응용 분야에는 herpes virus, HIV 및 tumor antigen과 같은 항원에 대한 T 세포 반응 연구가 포함됩니다. BD Biosciences는 세포 내 유세포 분석을 통해 intracellular cytokine을 측정하기위한 여러 솔루션을 제공합니다.
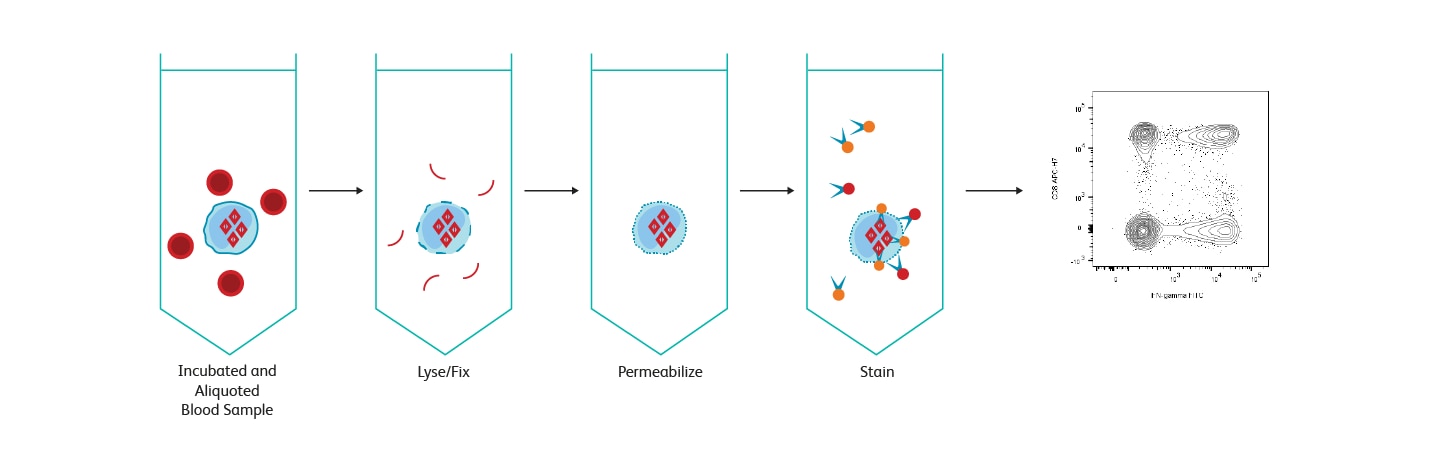
BD FastImmune ™ Cytokine System workflow 개요.
Intracellular signaling
BD Phosflow ™ Reagent 기술은 T cell subset-specific signaling process에 대한 kinetic information을 얻을 수 있는 강력한 수단을 제공합니다.
T cell은 항원 및 cytokine, kinase 및 transcription factor에 대한 receptor를 포함하여 여러 신호 전달 분자를 포함하는 복잡한 경로에 의해 활성화되고 조절됩니다. Protein phosphorylation (단백질 인산화)와 관련된 신호는 naïve CD4 + T cell을 Th1, Th2, Th9, Th17, Tfh 또는 Treg cell로 분화시키는데 역할을 합니다.
Detecting transient phosphorylation events: BD Phosflow™ Reagent technology
혁신적인 BD Phosflow ™ Reagent 기술은 cell line과 primary cell 모두에서 기저 및 유도된 protein phosphorylation event에 대한 intracellular data를 공개하는 최초의 완전한 유세포 분석 솔루션입니다. BD Phosflow ™ Reagent 접근법은 signaling protein의 phosphorylation 가 특정 T cell phenotype의 발현으로 이어지는 T cell 연구에 특히 유용합니다.
Secreted cytokines
Sample에서 분비된 cytokine을 검출하기 위해 BD는 여러 분석을 제공합니다. BD® Cytometric Bead Array (CBA) 기술을 사용하면 여러 가용성 cytokine을 동시에 정량 할 수 있으며, BD OptEIA™ ELISA Reagents 은 cytokine 정량을 위해 설계되었습니다. BD® ELISPOT Reagents 는 cytokine-producing cell의 빈도를 측정할 수 있으며 BD® In Vivo Capture Assay는 생체 내에서 직접 cytokine을 capture하여 정량화 할 수 있습니다.
Regulatory T cell monitoring
FoxP3 staining
FoxP3 (Scurfin, IPEX 및 JM2라고도 함)은 transcription factor의 forkhead 또는 winged helix family의 transcriptional repression factor 입니다.1 FoxP3는 조절 활성을 갖는 모든 CD4 + Treg cell에서 발현되는 것으로 밝혀졌습니다. FoxP3의 돌연변이는 생쥐의 유전된 자가면역 질환 Scurfy 및 인간의IPEX (immune dysregulation, polyendocrinopathy, and enteropathy X-linked syndrome)와 관련이 있습니다.
FoxP3는 분리된 Tregs의 순도와 수율을 확인하거나 고정된 Treg cell을 특성분석 하는데 유용하게 사용됩니다. 그러나 FoxP3 staining에는 cell의 고정 및 투과성이 필요하기 때문에 생존 가능한 Treg cell을 분리하는 데 적합하지 않습니다. 이러한 경우 CD25 + CD127- surface signature가 더 나은 solution입니다. BD Biosciences의 human FoxP3 monoclonal antibody clone 259D / C7은 현재 확인 된 human FoxP3 transcription factor 의 모든 identified isoform과 반응하며 cynomolgus, rhesus 및 baboon 와 교차 반응합니다.
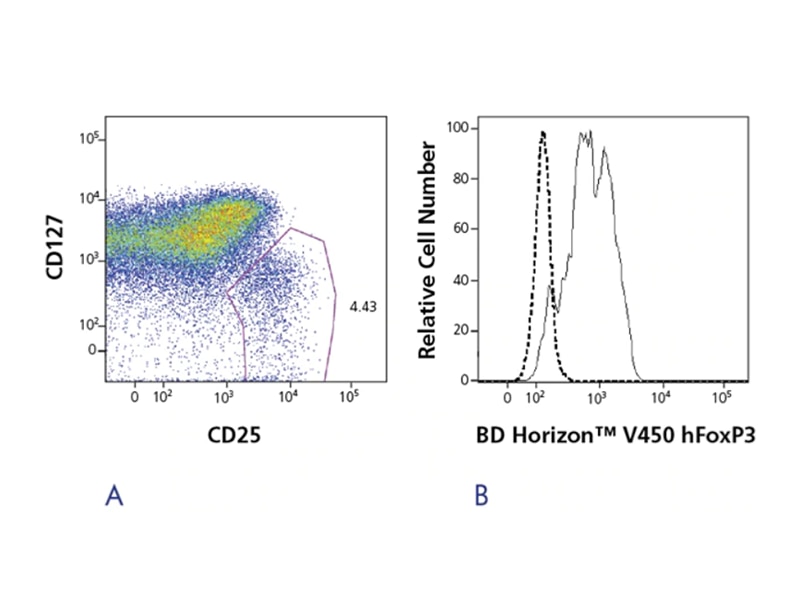
BD Pharmingen ™ Human FoxP3 antibody는 다양한 크기와 접합체로 제공되며 FoxP3 positive Tregs 측정용 시약입니다. 사용하기 쉬운 buffer 시스템을 통해 연구원은 최대 72 시간까지 샘플을 동결할 수 있는 옵션을 사용하여 몇 가지 간단한 단계만으로 cell을 고정하고 투과시킬 수 있습니다. FoxP3는 Treg 식별, 분리 및 특성분석에 일반적으로 사용되는 marker이지만 Tregs는 매우 활발한 연구 분야이며 새로운 표적 목록이 문헌에 발표되었습니다. 이러한 새로운 발견을 지원하기 위해 BD Biosciences의 새로운 고품질 시약 및 솔루션 포트폴리오는 계속해서 성장하고 있습니다.
CD39: Enhanced characterization of Tregs
이전에는 주로 B cell, dendritic cell 및 T cell의 specific subset에 국한된 CD39는 최근 human과 mouse의 CD4 + Tregs에서 FoxP3와 공동 발현되는 것으로 나타났습니다.2이 발견은 다음과 같은 cell surface marker 목록에 추가되었습니다. CD25, CD45RA, HLA-DR 및 CTLA4로, CD4 + Tregs의 식별 및 기능적 특성분석에 중요합니다.
Extracellular ATP와 metabolite는 광범위한 세포 및 기관 기능을 조절하는 강력한 regulatory molecule입니다. Cell ATP 방출은 조직 파괴의 지표이자 면역반응을 활성화하는 위험 신호입니다. CD39는 extracellular ATP (또는 다른 triphosphates)를 AMP와 같은 각각의 nucleotide로 가수 분해합니다. Extracellular nucleoside monophosphate는 차례로 가용성 또는 membrane bound ecto-5 'nucleotidase (CD73)에 의해 nucleoside (예 : adenosine)로 빠르게 분해됩니다. cell 주위 아데노신은 anti-inflammatory T cell response를 매개합니다. CD39와 CD73의 동시 발현은 Tregs가 매개하는 면역 억제의 핵심 메커니즘 중 하나로 여겨집니다 .3
BD Pharmingen ™ Anti-Human CD39 (클론 TÜ66) Monoclonal Antibody는 human Tregs의 marker이며 유세포 분석을 위한 즉시 사용 가능한 시약 키트에서 PE 및 APC 접합체로 제공됩니다. TÜ66은 ectonucleoside triphosphate diphospho-hydrolase (E-NTPDases) 계열에 속하는 ectoenzyme 인 ENTPD1을 인식합니다. 이 family의 구성원은 extracellular nucleoside triphosphate pool (NTP)을 제어하는 extracellular nucleotide catabolism 에 관여합니다.
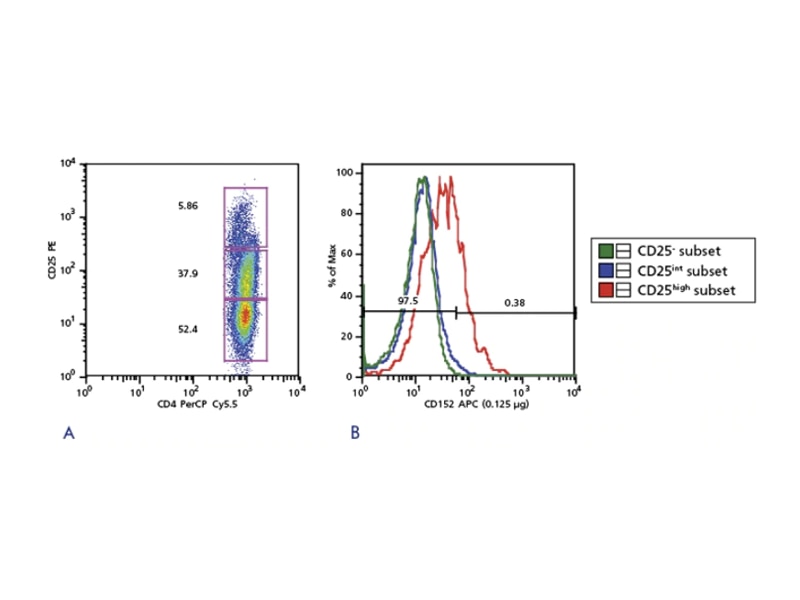
CD152: CTLA4
Cytotoxic T lymphocyte antigen 4 (CTLA-4 또는 CD152)는 Treg 억제 기능에 중요합니다. CD152의 Blockage 은 Treg의 억제활동을 손상시킵니다. CD152 expression의 이상은 rheumatoid arthritis 과 같은 autoimmune disease에서 역할을 하는 것으로 보고되었습니다 .15 정의된 집단, 기존 marker 및 새로운 marker의 존재는 Treg 생물학에서 흥미로운 새로운 발견에 크게 기여할 것입니다.
Treg enrichment
Treg은 cell의 small population을 나타냅니다. Enrichment가 downstream analysis에 필요한 경우가 있습니다. Tregs의 전체 또는 subpopulation을 enrichment하기 위한 몇 가지 방법이 있습니다. FoxP3는 현재 Tregs에 가장 많이 사용되는 marker로 간주되지만 cell 내 위치 파악으로 인해 viable Tregs의 분리에 사용이 금지됩니다. Enrichment에 사용되는 다른 marker는 negative, positive 또는 이 둘의 조합으로 사용됩니다. 보고된 negative selection 방법 중 하나는 CD127 및 CD49d를 발현하는 cell을 제거하는 것입니다. CD4 + 및 최고 수준의 CD25를 발현하는 cell은 positive selection에 사용됩니다. 조합 방법은 cell sorting 전에 contaminating population을 제거하기 위해 magnetic bead를 사용할 수 있습니다. 가장 많이 사용되는 접근법 중 하나는 CD4 +, CD25 +, CD127- 세포를 enrich하는 것입니다.
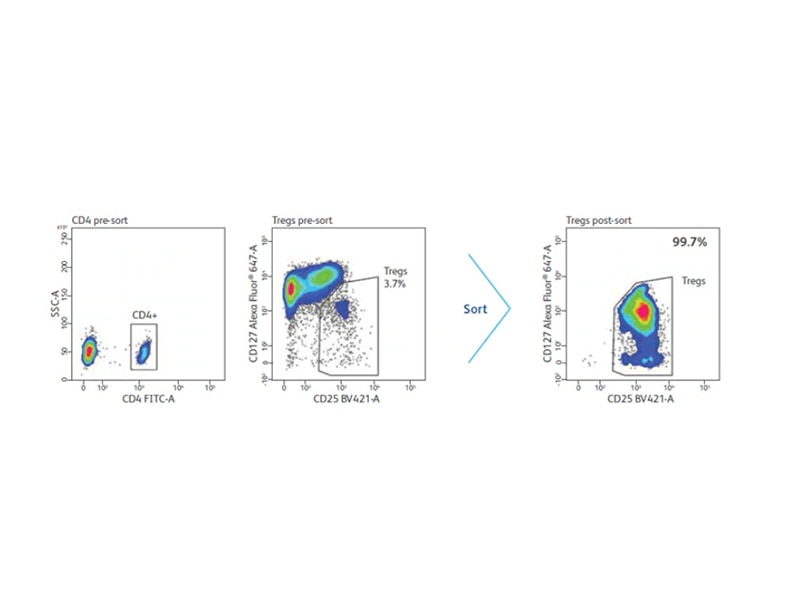
Enrichment of Tregs with CD4 and CD25
Huma Treg population에 대한 초기 분석 결과, CD25의 highest level expression하는 ex vivo cell (전체 CD4 T cell의 약 2 ~ 3 %)만이 in vitro suppressive activity를 보이는 것으로 나타났습니다. CD25 cell는 Tregs으로 간주됩니다. 더욱이, CD25의 낮거나 중간 수준을 발현하는 cell은 생체 외에서 직접 어떠한 억제 활성도 나타내지 않는 것으로 간주되었습니다.
또한 CD25 expression의 높고 낮은 수준에 대한 합의가 이루어지지 않았으며 유세포 분석 세포 분류를 통해 생존 가능한 human Treg를 얻는 데 사용하는 것으로 사용을 제한했습니다. 그 결과, 많은 연구자들은 CD25 expression이 가장 높은 cell만을 선택하여 분리된 Tregs의 yield을 크게 줄였습니다. 이러한 결과는 human Tregs에만 존재하는 CD4 및 CD25 이외의 cells surface marker를 식별하기 위한 연구를 강화했습니다.4
인간 Treg의 yield를 높이기 위한 CD4 + T cell의 자성 기반 pre-enrichment
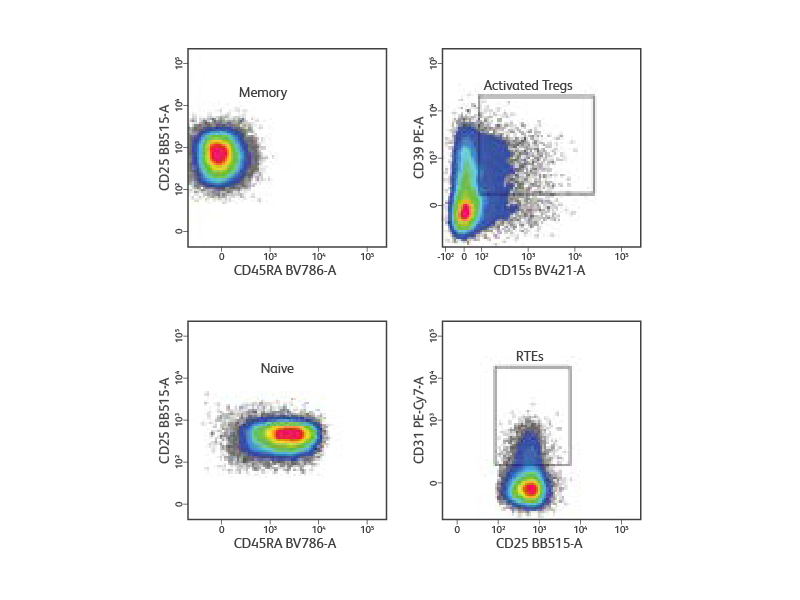
건강한 공여자의 말초혈액 단핵세포 (PBMCs)를 표면형 마커 칵테일 (CD3, CD4, CD25, CD127, and CD45RA)로 염색하여 Treg의 subset을 확인했습니다. Light Scatter 부분을 기반으로 한 Singlet과 림프구 Gating에서 CD3+CD4+ T 세포를 Gating 했습니다 (not shown). Treg은 CD127low/neg CD25high 세포로 간주했으며, Purity 모드에서 5,000 events/sec으로 Treg을 CD45RA+ naïve 세포와 CD45RA- memory Treg으로 분류했습니다. 분류 후 분석으로 Memory Treg과 naïve Treg의 동종 세포군 (homogenous populations)을 확인했습니다. 분류된 세포의 면역 표현형 확인을 위해 표면형 마커 (CD31, CD39, CD15s)를 추가 염색한 결과, CD31+ recent thymic emigrants (RTEs)이 CD45RA+ naive Treg에서 확인된 반면, 매우 활성화된 Treg은 CD45RA- memory Treg에서 확인되었습니다.
참고문헌
- Di Caro V, D'Anneo A, Phillips B, et al. Interleukin-7 matures suppressive CD127(+) forkhead box P3 (FoxP3)(+) T cells into CD127(-) CD25(high) FoxP3(+) regulatory T cells. Clin Exp Immunol. 2011;165(1):60-76. doi:10.1111/j.1365-2249.2011.04334.x
- Tøndell A, Wahl SGF, Sponaas AM, Sørhaug S, Børset M, Haug M. Ectonucleotidase CD39 and checkpoint signalling receptor programmed death 1 are highly elevated in intratumoral immune cells in non-small-cell lung cancer. Transl Oncol. 2020;13(1):17-24. doi:10.1016/j.tranon.2019.09.003
- de Oliveira Bravo M, Carvalho JL, Saldanha-Araujo F. Adenosine production: a common path for mesenchymal stem-cell and regulatory T-cell-mediated immunosuppression. Purinergic Signal. 2016;12(4):595-609. doi:10.1007/s11302-016-9529-0
- Attias M, Al-Aubodah T, Piccirillo CA. Mechanisms of human FoxP3+ Treg cell development and function in health and disease. Clin Exp Immunol. 2019;197(1):36-51. doi:10.1111/cei.13290
-
Application Notes
-
Brochures
-
자주묻는 질문
-
Product Information Sheets
-
BD® CBA Human and Mouse Th1/Th2/Th17 Kit
-
BD Pharmingen™ CD4+ T Cell Phenotyping Kits
-
BD Pharmingen™ Transcription Factor Buffer Set
-
BD Human Regulatory T Cell Cocktail (CD4/CD25/CD127)
-
Human CD39 Reagents
-
Human FoxP3
-
Human Th17 Research Products
-
Human and Mouse Reactive T-bet Monoclonal Antibodies
-
Mouse Foxp3
-
Mouse Th17 Reagents
-
Unique Markers for the Study of Human Activated Regulatory T Cells: GARP, LAP, and SATB1
-
Protocols
- Activation of Immune Cells for Cytokine Production
- BD Pharmingen™ Transcription Factor Buffer Set, Cat. Nos. 562725, 562574
-
BD Cytofix/Cytoperm Method for Immunofluorescent Staining of Intracellular Cytokines for Flow Cytometric Analysis
-
CD3 Plate Stimulation Protocol of Murine T Cells for the Detection of Activation Markers
-
Protocol for CD3 Stimulation of Human T Cells for the Detection of Activation Markers
-
Simultaneous Measurement of Cell Surface Markers with FoxP3 and Stat5 (pY694) in IL-2– Stimulated Human PBMCs using BD Cytofix™ Fixation Buffer and BD Phosflow™ Perm Buffer III
-
Webinars
-
Complete, Novel Reagent and Instrumentation Solutions for the Sorting of Viable, Functional Regulatory T Cells
-
Optimizing Intracellular Flow Cytometry: Simultaneous Detection of Cytokines and Transcription Factors
-
Simplify Immunophenotyping Using Kits & Templates on the BD Accuri™ C6 Flow Cytometer
-
Simultaneous Correlation of Cytokine Production with Treg and Th17 Cell Proliferation
연구용입니다. 진단용 또는 치료용으로 사용할 수 없습니다.
Cy는 Global Life Sciences Solutions Germany GmbH 또는 Cytiva로 사업을 하는 계열사의 상표입니다.
Alexa Fluor는 Life Technologies Corporation의 상표입니다.