Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

세포 기반 assays
세포 기반 assay는 증식, 생존력, 세포 사멸 및 조절 네트워크와 같은 세포 과정과 인산화 및 cytokine 분비와 같은 세포의 기능적 측면을 측정합니다. 세포 기반 분석을 사용하여 관심있는 전체 경로를 조사하고 여러 단계를 측정하여 실제로 세포 내부에서 일어나는 일에 대한 기능적 판독 값을 산출할 수 있습니다. BD Biosciences는 세포 내 cytokine 신호 전달, 세포주기, 세포 생존력 및 증식 측정 및 인산화 이벤트 평가에 대한 여러 분석을 제공합니다.
세포주기, 증식, 생존력 및 세포사멸 분석
진핵 세포의 세포 성장, 복제 및 분열은 세포주기 라고하는 고도로 통제된 일련의 사건에 따라 발생합니다. 적응 면역에서 특정 T 및 B 림프구는 외래 항원 자극에 반응하여 클론 확장 (분할, 증식 및 분화)을 겪습니다. Flow cytometry, immunofluorescence 또는 immunohistochemistry를 사용하여 세포주기 상태를 신속하게 결정하고, 자극에 대한 세포 반응을 결정할 수 있습니다.
세포주기 및 세포 DNA content 분석
BD Biosciences는 세포주기를 연구하기 위한 다양한 시약을 제공합니다. 시약에는 PI (propidium iodide) 및 7-aminoactinomycin D (7-AAD)와 같은 핵산 염료가 포함됩니다. 또한 BD Cycletest ™ Plus Reagent Kit에는 단백질을 분해하는 PI 및 기타 시약과 RNA가 포함되어 있어 보다 정확한 DNA 측정이 가능합니다. 이후 샘플은 유세포 분석을 사용하여 분석되어 배수성을 평가하고, 비정상적인 DNA 스템 라인을 식별하고, DNA 인덱스 (DI) 및 줄기 라인의 세포주기 단계 분포를 추정합니다. 세포주기 단계에서 DNA 수준이 변경되어 7-AAD와 같은 DNA 염료를 사용하여 특징적인 세포 DNA content 프로필을 생성할 수 있습니다 (그림 참조).
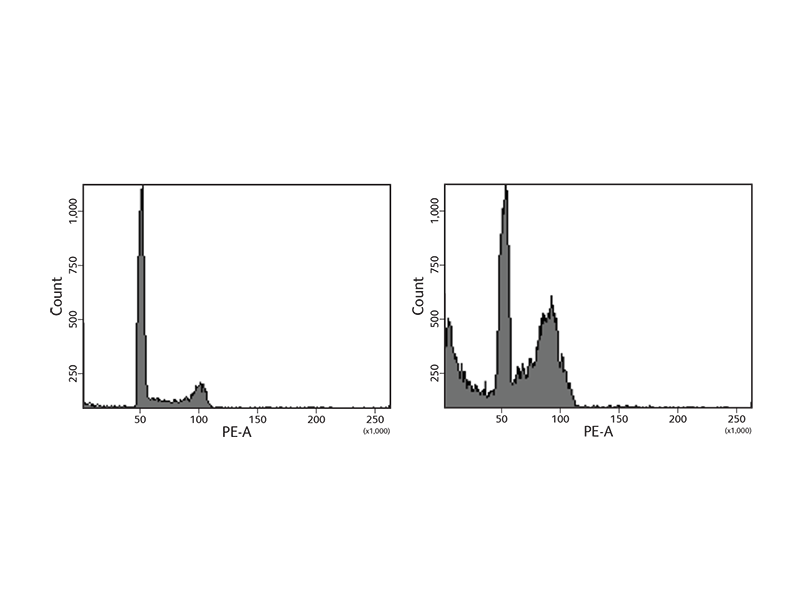
세포가 세포주기의 단계를 거치면서 히스톤 H3 Ser28과 같은 단백질이 변형되거나 발현이 변경됩니다. DNA 복제를 용이하게하기 위해 히스톤이 수정되어 복제 기계가 들어갈 수 있도록 염색질이 열립니다. 세포주기 연구를 더욱 지원하기 위해 BD Biosciences는 이러한 단백질에 대한 항체를 전달하여 이미징 또는 유세포 분석 애플리케이션에 사용합니다.
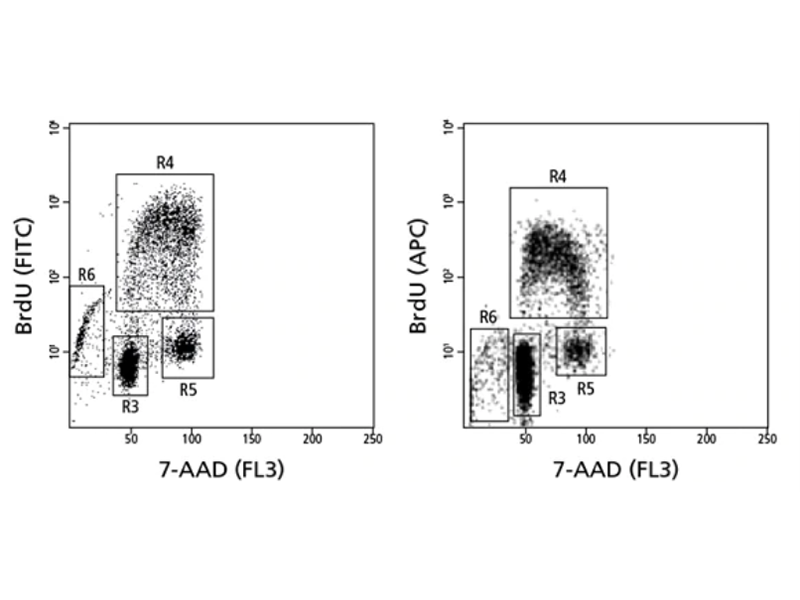
혼입된 브로모데옥시우리딘 (BrdU) 및 총 DNA 수준 (7-AAD)에 대해 염색된 집단의 세포주기 분석.
세포주기 분석을 위한 세포주기 및 BD Biosciences 솔루션에 대해 자세히 알아보십시오.
인간 PBMC를 항 -CD3 / CD28로 48 시간 동안 자극하고 PMA + ionomycine으로 4 시간 동안 재 자극 한 후 BrdU를 마지막 1 시간 동안 첨가했습니다. 이어서 세포를 수확하고 BrdU 염색 프로토콜을 사용하여 염색했습니다. 게이트 R3은 G0 기 세포를 포함하고, 게이트 G4는 S 기 세포를 포함하고, 게이트 R5는 G2 / M 기 세포를 포함하고, 게이트 R6은 핵산 함량을 상실하기 시작하는 아토포시스 또는 괴사 세포를 포함한다.
세포 증식 assay
세포 증식은 성장과 분열의 결과로 세포 수가 증가하는 것입니다. 세포 증식과 Apoptosis의 균형은 발달과 정상 조직 항상성 모두에 중요합니다. Cytokine 치료 또는 정제된 항체와의 수용체 가교와 같은 다중 자극은 세포 증식에 영향을 미칠 수 있습니다.
BrdU를 이용한 세포 증식 측정
BD Biosciences는 de novo DNA 합성을 측정하는데 사용되는 DNA 전구체 티미 딘의 유사 체인 BrdU를 측정하여 증식하는 세포를 검출하도록 설계된 일련의 항체 및 키트를 제공합니다.
세포주기 (DNA 합성)의 S 기 동안 BrdU는 새로 합성된 DNA에 통합되며 항 -BrdU 특정 항체에 의해 쉽게 검출될 수 있습니다. BrdU 검출 용으로 설계된 BD 항체 및 키트는 세포 내 유세포 분석 및 면역조직화학법에 모두에 사용할 수 있으며 BD Horizon ™ Violet 450 (V450), BD Horizon Brilliant Violet ™ 510 (BV510), BD Pharmingen ™ PerCP-Cy5.5 및 기타 포맷을 포함합니다.
DNA 증가 외에도 특정 단백질의 수준도 세포 증식의 결과로 증가합니다. 예를 들어, Ki67은 분열하는 세포의 핵에서 발현되는 항원입니다. 그러나 세포주기의 G0 기에서는 검출되지 않습니다. Ki67은 BrdU 및 VPD450과 같은 다른 증식 마커와 결합하여 신뢰도를 높일 수 있습니다. 이러한 마커는 세포 표면 및 기타 유형의 마커와 결합하여 세포 하위 집합 및 신호 경로에 대한 추가 정보를 얻을 수도 있습니다.
Apoptosis 및 세포사멸 분석 assay
Apoptosis 과정은 특정 형태학적 특징이 있습니다. 여기에는 원형질막의 변화 (예 : 막 대칭 상실 및 막 부착 상실), 세포질과 핵의 응축, 단백질 절단 및 DNA의 뉴클레오좀 간 절단이 포함됩니다. 이 과정의 마지막 단계에서 죽어가는 세포는 세포사멸체로 단편화되고 결과적으로 주변 세포에 대한 심각한 염증성 손상없이 식세포에 의해 제거됩니다. BD Biosciences는 세포 사멸 과정의 여러 단계에서 지표를 측정하기 위한 전체 범위의 세포 사멸 탐지 도구 및 기술을 제공합니다.
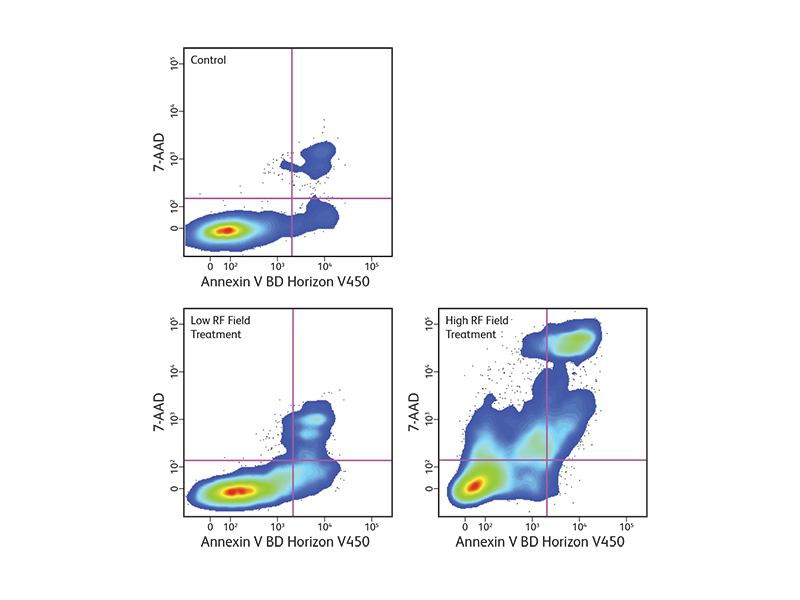
원형질막의 변화는 살아있는 세포에서 발견되는 세포 사멸 과정의 특징중 하나입니다. Apoptosis 는 일반적으로 원형질막의 세포질 표면에 위치한 포스파티딜세린 (PS)의 존재에 의해 검출될 수 있습니다. Apoptosis 동안 PS는 원형질막의 외부 막으로 이동하며 칼슘이 존재할 때 형광 색소 표지된 Annexin V에 결합하여 유세포 분석 및 세포 이미징에 의해 검출될 수 있습니다.
BD Biosciences는 FITC, PE, Violet 레이저 용 BD Horizon ™ BV421, UV 레이저 용 BD Horizon Brilliant ™ UV 395 (BUV395) 등 여러 형광으로 Annexin V를 제공합니다. 이러한 새로운 형광이 추가됨에 따라 이질적인 세포 하위 집합 내에서 Apoptosis를 관찰하기 위한 더 복잡한 분석을 개발할 수 있습니다.
원형질막이 손상되면 세포내Annexin V도 노출되기 때문에 7-AAD와 같은 막-불 투과성 염료는 일반적으로 세포사멸을 제외하기 위해 Apoptosis와 사멸 세포를 구별하는데 사용됩니다. Annexin V로 염색된 세포 집단은 Apoptosis 세포 집단만을 나타냅니다.
절단된 카스파제 및 PARP 측정
Apoptosis의 특징 중 가장 일관되게 관찰되는 특징 중 하나는 caspase라고 불리는 일련의 proteases의 활성화입니다. Caspase는 apoptosis의 초기 단계에 aspartate 잔기의 절단이 일어나며 활성화됩니다. 활성 caspase는 poly -ADP 리보스 중합 효소 (PARP), 기타 caspase및 기타 단백질 기질을 포함하여 많은 단백질을 한꺼번에 절단할 수 있습니다. 이것은 세포 구조와 기능의 손실로 이어지고 궁극적으로 세포 사멸을 초래합니다. Caspase-9, -8 및 -3은 apoptosis와 관련이 있는데 미토콘드리아 경로는 caspase -9, Fas / CD95 경로는 caspase -8, 그리고 여러 경로에 의해 활성화된 caspase-3는 apoptosis downstream 에 관여합니다.
BD Biosciences는 caspase, 특히 caspase -3을 측정하기 위한 다양한 시약을 제공합니다. 유세포 분석, 이미징, ELISA 및 western blotting에 사용할 수 있는 활성 형태의 caspase에 대한 항체를 제공합니다.
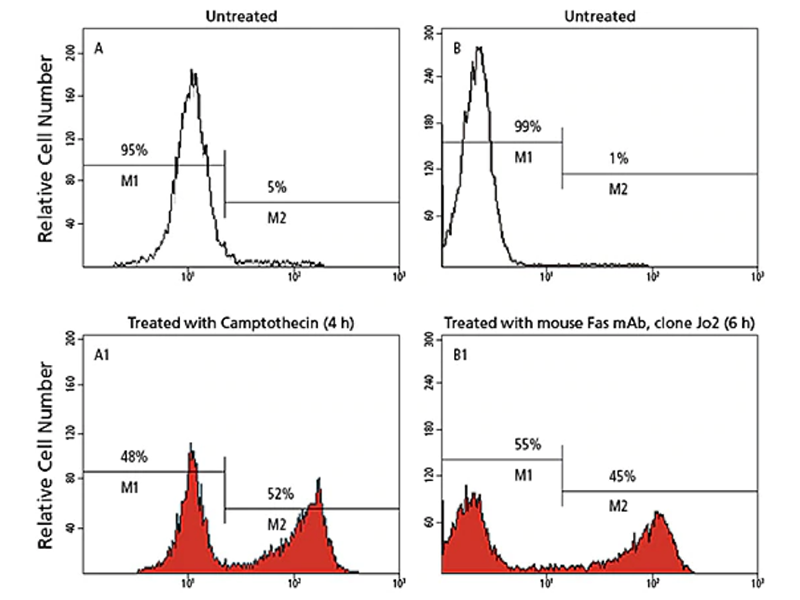
Caspase-3 절단 / 억제 반응
활성 caspases -3은 형광성 Ac-DEVD-AMC 기질에 결합하여 aspartic acid (D)와 AMC 사이를 절단하여 형광성 AMC를 방출하고 AMC 형광은 UV 분광 형광법에 의해 정량화됩니다. Ac-DEVD-CHO aldehyde 억제제는 caspases -3 활성 부위에 강하게 결합하여 기질결합을 차단합니다. 따라서 Ac-DEVD-AMC는 절단되지 않고 형광이 방출되지 않습니다.
BD Biosciences는 세포주기, 증식, 세포사멸 및 Apoptosis를 분석하기 위한 여러 프로토콜을 제공합니다.
인 단백질 분석
티로신, 세린 및 트레오닌 잔기의 인산화는 다양한 세포 사건과 관련된 단백질 활동의 제어에 중요합니다. 다양한 kinase 및 phosphotase는 T 및 B 세포 신호, 세포 사멸, 성장 및 세포주기 제어, cytokine, chemokine 및 스트레스 반응과 관련된 신호와 같은 다양한 세포 신호 전달 경로에서 세포 내 단백질 인산화를 조절합니다. 역사적으로 인 단백질 검출은 방사성 kinase 분석 및 phospho 아미노산 라벨링과 같은 기술을 사용하여 수행되었습니다. 그러나 phospho 특이적 항체의 출현은 western blotting, 면역 침전 및 면역 형광 현미경과 같은 보다 간단한 기술의 사용을 촉진했습니다. 그러나 이러한 기술은 상대적으로 많은 양의 샘플이 필요하고 시간이 많이 걸리며 진정한 정량적 결과를 생성하지 못하며 다중 매개 변수 분석을 할 수 없다는 몇 가지 단점이 있습니다.
Phospho 단백질 분석은 phospho 단백질 분석을 향상시키기 위해 phospho-특이적 항체와 유세포 분석의 장점을 결합합니다. 유세포 분석은 작은 샘플 크기만 필요하며 단일 세포 및 별개의 세포 하위 집단에 대한 신속하고 정량적인 다중 매개 변수 분석을 수행하는 데 이상적입니다. BD Phosflow ™ 시약을 사용하면 유세포 분석을 사용하여 단일 세포 또는 하위 집단의 세포 내 phospho 단백질 분석이 가능합니다.
High-content 세포 이미징을 통해 연구자들은 단백질 인산화를 시각화 할 수 있고, 미세 환경 및 단백질-단백질 상호 작용 및 전위 이벤트를 동시에 연구할 수 있습니다.
일시적 인산화 이벤트 감지: BD Phosflow ™ Reagent 기술
혁신적인 BD Phosflow ™ Reagent 기술은 세포주와 일차 세포 모두에서 기저 및 유도된 단백질 인산화 이벤트에 대한 세포 내 데이터를 공개하는 최초의 완전한 유세포 분석 솔루션입니다. BD Phosflow ™ Reagent 접근법은 신호 단백질의 인산화가 특정 T 세포 표현형의 발현으로 이어지는 T cell 연구에 특히 유용합니다.
BD Biosciences BD Phosflow ™ 프로토콜은 다양한 샘플 유형에 사용됩니다.
BD Cytofix / Cytoperm ™ 시약 방법
BD Cytofix / Cytoperm ™ Reagent 방법 및 관련 시약은 기본 연구의 광범위한 실험 요구를 해결합니다. 광범위한 cytokine 및 여러 종을 위한 제품으로 BD Cytofix / Cytoperm ™ Reagents는 세포 내 cytokine 염색에 최대한의 유연성을 제공합니다. BD Biosciences는 세포내 유세포 분석을 통해 세포 내 cytokine을 측정하기위한 여러 솔루션을 제공합니다.
BD FastImmune ™ 시스템
BD FastImmune ™ 시스템은 인체 샘플에 대한 응용 연구의 요구 사항을 충족하도록 설계되었습니다. 완전한 시스템에 초점을 맞춘 이 접근법은 질병 중 면역 상태 또는 백신 후보에 대한 면역 반응을 모니터링하는 연구 연구에 적합합니다. BD FastImmune ™ CD4 cell 내 cytokine 검출 키트 Anti-Hu-TNF-α / CD69 / CD4 / CD3은 전혈의 항원 활성화 CD4 + T cell에서 세포 내 cytokine 및 활성화 마커 CD69를 검출하도록 설계되었습니다. 응용 분야에는 헤르페스 바이러스, HIV 및 종양 항원과 같은 항원에 대한 T cell 반응 연구가 포함됩니다. BD Biosciences는 세포내 유세포 분석을 통해 세포 내 cytokine을 측정하기위한 여러 솔루션을 제공합니다.
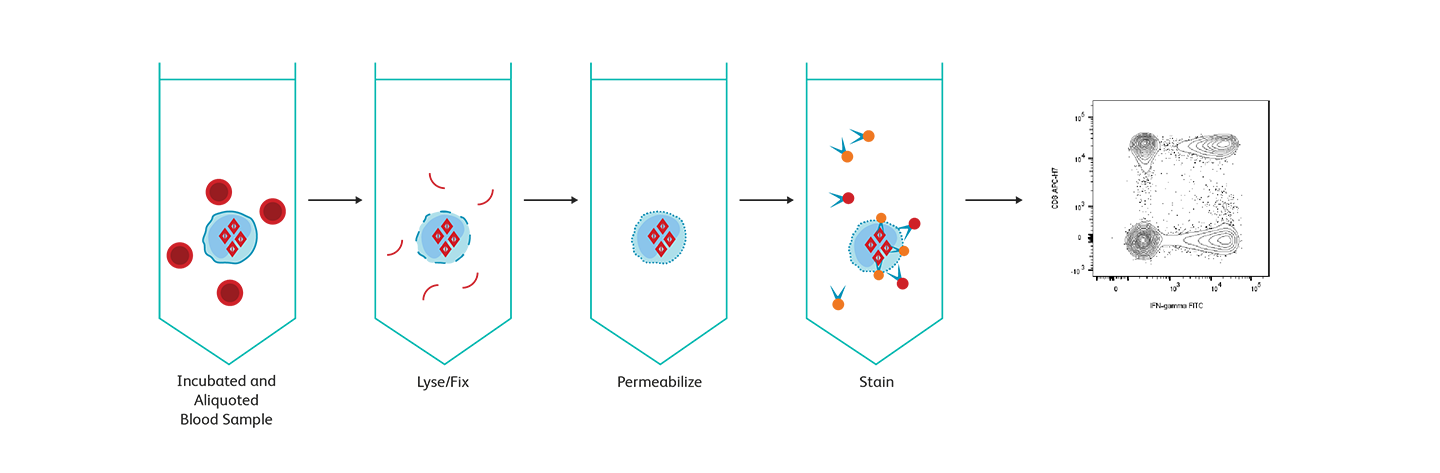
BD FastImmune ™ Cytokine 시스템 워크플로우 개요.
세포내 cytokine 분석
세포 내 단백질 검출을 위해서는 형광 항체가 관심 표적 단백질에 들어가서 검출할 수 있도록 세포를 고정하고 투과화해야 합니다. 다른 항원은 고정 및 투과성에 대한 민감도와 요구 사항이 다르므로 프로토콜의 추가 최적화가 필요합니다. 분비된 단백질인 cytokine 을 검출하기 위해서는 단백질 수송 억제제가 세포 내부에 단백질을 가두어야 합니다. BD Biosciences는 세포내 cytokine 검출을 위해 널리 사용되는 두 가지 분석 시스템인 BD Cytofix / Cytoperm ™ Reagents 및 BD FastImmune ™ Cytokine System을 제공합니다. 두 시스템 모두 연구자들에게 BD 유세포 분석 제품으로써 알려진 높은 수준의 품질과 재현성을 가지고 있고, 함께 사용하도록 최적화되어 있으므로 시약 및 프로토콜을 쉽게 사용하며 확신을 가지고 사용할 수 있습니다. BD Phosflow ™ 시약은 multiolor 유세포 분석을 사용하여 T cell 신호와 관련된 인산화 단백질의 수준을 측정하고 데이터를 하위 집합 식별과 결합하는 데 도움이 됩니다.
분비 cytokine 분석
샘플 내에서 분비된 cytokine을 검출하기 위해 BD는 여러 분석을 제공합니다. BD® Cytometric Bead Array (CBA) 기술을 사용하면 이용 가능한 여러 cytokine을 동시에 정량할 수 있으며, BD OptEIA ™ ELISA 시약은 단일 cytokine정량을 위해 설계되었습니다. BD® ELISPOT Reagents는 cytokine생성 세포의 빈도를 측정 할 수 있으며 BD® In Vivo Capture Assay는 생체 내에서 직접 cytokine을 캡처하여 정량화 할 수 있습니다.
BD Biosciences는 ELISA 및 기타 면역 분석을 위한 여러 프로토콜을 제공합니다.
Chemokine 수용체에 대한 생물학적 분석
화학 주성 분석 및 칼슘 동원 assay는 Chemokine 과 그 수용체의 생물학적 활성을 특성화하는 데 사용됩니다.
화학 주성 분석
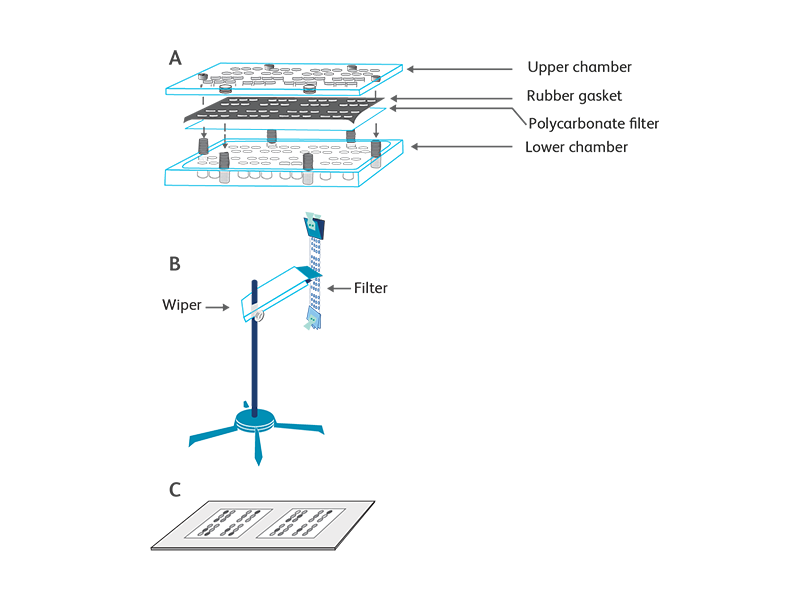
화학 주성 분석은 Chemokine 구배에 대한 반응으로 표적 세포의 방향성 이동을 기반으로 합니다. 대부분의 분석에 사용되는 장치는 1960 년대에 개발 된 Boyden 챔버입니다 .1 현대의 화학 주성 분석은 세포 외 기질 단백질 (예 : 콜라겐, 피브로넥틴) 또는 내피 세포로 막을 사전 코팅하는 것 또는 생체 내 환경을 모방하는 단층과 같은 여러 변형을 적용했습니다. BD Biosciences에서 사용하는 화학 주성 분석은 48 well 화학 주성 챔버 (Neuro Probe, Cabin John, MD)를 이용합니다.2
세포 용해시 젖산 탈수소 효소 (LDH)를 측정하여 이동된 세포를 열거하는 또 다른 변형된 화학 주성 분석은 Chemokine 의 생물학적 활성을 결정하는데도 사용됩니다. 간단히 말해서, 3 또는 5μm 기공 크기의 멤브레인이 있는 트랜스 well 삽입물은 대조군과 Chemokine 을 포함하는 24 well 플레이트의 well에 현탁됩니다. 표적 세포는 transwell 삽입물에 추가됩니다. 배양 후 이동된 세포의 수는 LDH에 의해 결정됩니다.
분석 3 방출된 LDH의 양은 테트라졸륨염 (INT)이 ELISA 플레이트 판독기를 사용하여 490nm 파장의 빛에서 쉽게 측정할 수 있는 적색 포르 마잔으로의 효소 전환에 비례합니다.
칼슘 동원 분석
Cytosolic free Ca2+ 농도 ([Ca2 +] i)의 일시적인 증가는 세포 신호 전달에 관여하는 많은 리간드 막 횡단 수용체 시스템에 대한 세포 활성화의 표시를 제공할 수 있습니다. 이러한 이유로 리간드에 의해 유발되는 일시적인 [Ca2 +] i 플럭스 수준을 측정하거나 활성화 리간드 또는 수용체에 대한 항체에 의해 방지되는 분석을 사용하여 이러한 생물학적 활성 분자의 수준과 특정 활성을 결정할 수 있습니다.
칼슘 이온은 세포 내 신호 전달에서 독특한 역할을 하며 세포 신호 전달 경로를 위한 중요한 두 번째 메신저로 간주됩니다. Chemokine, 아나필라톡신 및 기타 염증 매개체는 세포 수용체에 결합할 때 칼슘 동원 반응을 유발할 수 있습니다. 이 경우 수용체-리간드 상호 작용은 막 내부에 위치한 구아닌뉴클레오티드 결합 단백질을 활성화합니다. 결과적으로, 이종삼합체 G 단백질은 포스파티딜이노시톨 4,5- 비스포스페이트를 절단하여 포스포리파제 C를 활성화시켜 디아실글리세롤 및 이노시톨트리포스페이트를 방출합니다. 이노시톨트리포스페이트는 세포 내 저장에서 Ca2 +의 방출을 유발하는 반면, diacylglycerol과 증가된 세포질 Ca2 + 수준은 세포 내부의 단백질 kinase C의 활성화와 관련이 있습니다. 증가된 인산화 사건은 차례로 이러한 활성화된 세포에 의한 산화제 생산 및 분비 기능과 관련이 있습니다.
Indo-1 및 Fura-2와 같이 Ca2 +와 복합체를 형성한 후 형광 특성을 변경하는 다양한 형광 표시기 염료가 있습니다. 예를 들어, 여기 광 파장이 ~ 358nm로 설정된 분광형광계를 사용할 때 Indo-1의 형광 방출 최대 값은 염료가 Ca2 +로 포화되면 Ca2 +가없는 매체에서 ~ 485nm에서 ~ 405nm로 이동합니다. Ca2 + 결합 염료와 Ca2 +가없는 염료의 형광 비율은 [Ca2 +] i를 결정하는 데 사용할 수 있습니다. 이들 염료의 세포 투과성 아세톡시메틸 (AM) 에스테르는 세포에 수동적으로 로드 될 수 있으며, 세포 내 에스테라제에 의해 세포 불 투과성 생성물로 절단됩니다. 칼슘 동원 분석을 수행하기 위해 표적 세포에 Indo-1을로드하고 분광형광계 내부의 온도 제어 (37 ° C) 교반 큐벳에 넣고 358nm 파장의 빛으로 여기시킵니다. 405 및 485 nm에서 기준선 방출을 결정한 후 자극제 (Chemokine, 아나필라톡신 또는 기타 염증 매개체)를 세포 현탁액에 빠르게 주입합니다. 방출 된 형광등 신호는 다음 120 ~ 300 초 동안 지속적으로 모니터링되고 기록됩니다.
방출 비율 (E405 / E485)에 의해 반영된 세포질 유리 Ca2 +의 수준은 리간드가 자극성 인 경우 빠르게 증가합니다 (즉, 수용체가 세포 내 저장에서 Ca2 +의 동원을 초래하는 세포 내부의 신호를 세포질). 이 반응에 이어 [Ca2 +] i가 기준 수준으로 다시 감소합니다. 세포질 유리 Ca2 +의 일시적인 증가의 진폭은 ED50의 결정을 가능하게 하는 표적 세포를 활성화하는 데 사용되는 자극 리간드 농도에 따라 다릅니다.
기타 방법
위에서 설명한 방법 외에도 특정 Chemokine 의 생물학적 활성을 결정하기 위해 여러 가지 방법이 사용되었습니다. 여기에는 CC 및 CXC 케모카인 모두에 대한 CD11b / CD18 상향 조절 assay, CXC 케모카인에 대한 호중구 엘라스타제 또는 β- 글 쿠로니다제 방출 assay 및 호중구 산화 버스트 assay, MIP-1α 및 MIP-1β에 대한 조혈 콜로니 형성 assay 및 CC 케모카인에 대한 히스타민 방출 assay가 포함됩니다..
참고문헌
- Boyden S. The chemotactic effect of mixture of antibody and antigen on polymorphonuclear leukocytes. J Exp Med. 1962;115(3):453-466. doi: 10.1084/jem.115.3.453
- Leonard EJ, Sylvester I, Yoshimura T. Measurement of human neutrophil attractant protein-1 (NAP-1; IL-8). In Coligan JE, Kruisbeek M, Margulies DH, Shevach EM, Strober W, eds. Current Protocols in Immunology. Greene Publishing Associates and Wiley-Interscience; 1992.
- Nachlas MM, Margulies SI, Goldberg JD, Seligman AM. The determination of lactic dehydrogenase with a tetrazolium salt. Anal Biochem. 1960;1:317-326. doi: 10.1016/0003-2697(60)90029-4
연구용입니다. 진단용 또는 치료용으로 사용할 수 없습니다.
Cy는 Global Life Sciences Solutions Germany GmbH 또는 Cytiva로 사업을 하는 계열사의 상표입니다.