Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

이식(Transplantation)
줄기세포 이식은 암 환자의 혈액과 면역 세포 생산 능력을 회복하기 위해 고용량 화학요법 (high-dose chemotherapy, HDC) 후에 시행됩니다. 매년 3 만 명 이상의 혈액 관련 악성종양 환자가 HDC를 받고, 치료 반응이 만족스러운 경우 조혈모세포이식(hematopoietic stem cell transplantation, HSCT)을 할 수 있습니다.1 세포 선택의 광범위한 사용을 포함한 이식 기술의 발전은 기존 이식에서 발생했던 이환율 및 사망률을 현저히 감소시키는데 기여했습니다. 현재 HDC와 이식을 함께 사용하는 것이 다발성 골수종, first remission에서 급성 골수성 백혈병 및 중등도 비호지킨성 림프종의 표준 치료가 되었습니다.
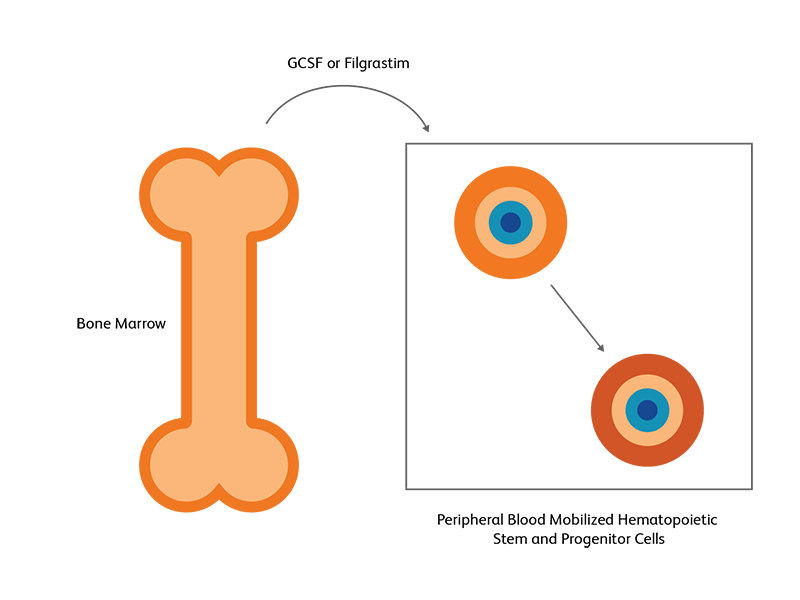
줄기세포 이식을 위한 골수 vs 말초혈액
골수에서 얻은 조혈줄기세포(HSC)는 growth factor 또는 화학요법에 대한 반응으로 말초 혈액으로 이동하도록 유도할 수 있습니다. 이는 자가 및 동종 HSCT에서 모두 사용됩니다2. HSC는 주로 bone marrow niches에서 발견되지만 HSC의 작은 조각이 말초 혈액에서 발견되는 경우도 있습니다. 3 화학요법과 같은 외인성 자극 후 또는 granulocyte colony stimulating factor (G-CSF) 및 filgrastim 등 growth factor를 이용하는 경우 말초 혈액의 HSC 수가 증가하여 골수에 있는 수보다 같거나 많아집니다. 이렇게 약리학적으로 유도된 HSC의 말초 혈액으로의 이동을 mobilization이라 부르고, 이는 이식을 위한 HSC 생성에서 선호되는 전략입니다. 3 자가줄기세포 이식은 거의 전적으로 말초 혈액을 사용하는 반면, allogeneic SCT 의 경우 말초 혈액의 T림프구가 위험을 야기할 수 있습니다. 2 Viable CD45 + / CD34 + 세포 수는 이식을 위한 검체의 품질을 결정합니다.
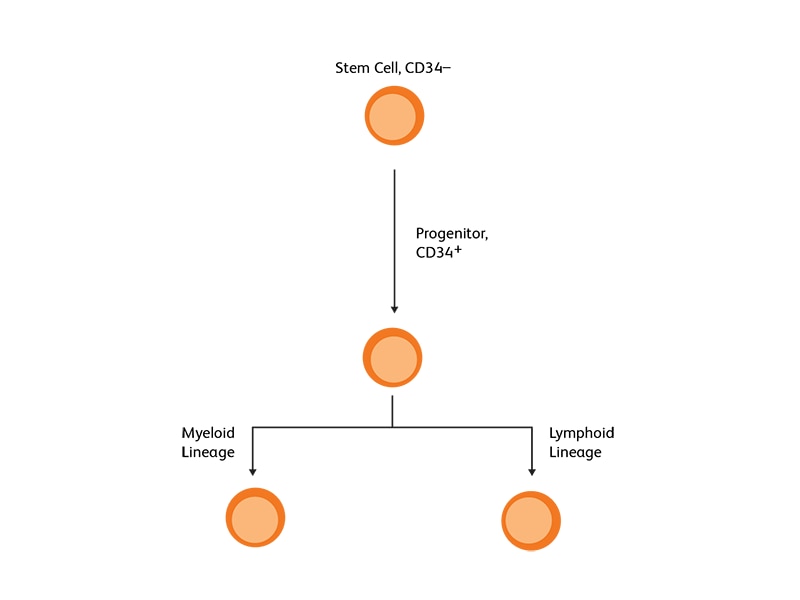
조혈줄기세포 marker로서의 CD34
막관통성 인산화 당단백질(transmembrane phosphoglycoprotein )인 CD34는 미성숙 조혈 전구체 세포 및 골수 및 혈액의 모든 조혈 colony-forming cell(단능 및 다능성 전구 세포 포함)에 존재합니다. 4 오랫동안 CD34 발현은 조혈 세포와 관련이 있으며 HSC의 marker로 간주되어 왔습니다. 다수의 조혈 악성종양의 경우, 화학 요법 이후 CD34 + 조혈 줄기/전구 세포의 수집 및 주입이 중요합니다. G-CSF는 거의 모든 자가 HSCT 및 다수의 동종 HSCT에 일반적으로 사용되는 mobilizing agent이며 CD34 + 농도를 증가시키는 것으로 알려져 있습니다.
CD34의 측정 및 선택
줄기세포 이식에서 용량 요구사항 프로토콜에서 정확한 CD34 측정이 중요합니다.5 정확하지 않은 결과가 높게 나오는 경우 CD34+ 세포의 권장 임계용량 미만으로 주입할 가능성이 있습니다. CD34+ 세포 집단을 정량화 하는 것은 mobilization 과정에서도 유용할 뿐만 아니라 충분한 CD34 + 세포가 수확되었는지 확인하기 위한 apheresis session 최적 타이밍을 결정하는 데에도 유용하게 사용할 수 있습니다. CD34 + HSC 및 전구 세포의 유세포 분석 계수는 골수 및 줄기세포 이식편의 평가를 위한 확립된 방법입니다.6 Milan / Mulhouse 및 ISHAGE (International Society of Hematotherapy and Graft Engineering) 프로토콜7 과 같은 이전의 유세포 분석 방법은 유세포 분석기와 자동 혈액 분석기 등의 2차 플랫폼을 사용하는 두 개의 플랫폼 이용 방식입니다. 최신 단일 플랫폼 방법에서는 절대 CD34+ 개수를 결정하기 위해 유세포 분석기만 사용합니다.6 유세포 분석을 통해 CD34+ 세포를 식별하기 위한 방법으로 CD34 분자에 대한 Fluorochrome-conjugated monoclonal antibodies 를 사용할 수도 있습니다. CD34+ 세포 식별 및 enumeration를 위한 유세포 분석 application은 빠르고 정량적이며 재현 가능한 방법을 제공하여 progenitor cell population 을 평가할 수 있도록 해줍니다. CD34 분자의 구조적 특성과 CD34 monoclonal antibodies 에 의해 측정된 epitope를 고려하는 표준화된ISHAGE 프로토콜7 의 개발은 CD34+ marker의 유세포 분석 기반 측정을 지원합니다.
BD Biosciences는 CD34+ 세포 enumeration을 위한 유세포 분석기 및 assays를 제공합니다.
BD® Stem Cell Enumeration (SCE) Assay는 총 생존가능한 백혈구 중 총 생존가능한 CD34+와 CD45+ 세포를 백분율로 나타냅니다. BD Trucount™ 기술을 통합하여 정확하고 재현가능한 단일 플랫폼 기술을 제공합니다.7 본 assay에서 cell population의 enumeration은 gating 및 분석을 위한 자동 또는 수동방법을 이용하여 실행할 수 있습니다.
Single tube assay는 절대 수 측정을 위해 개별 Trucount™ Tubes의 시약으로 샘플을 염색하여 수행됩니다. 샘플을 시약에 추가하면 시약의 형광 표지 항체가 세포 표면에 특이적으로 결합합니다. 또한 BD Trucount™ Tube의 동결 건조된 펠릿이 용해되어 알려진 수만큼의 fluorescent beads를 방출합니다. 7-AAD dye를 추가하여 세포의 생존력을 평가합니다. 7-AAD+인 세포는 생존 불가합니다. 유세포 분석기에서 시료를 획득하기 전 적혈구를 용해하기 위해 염화암모늄을 첨가합니다. 샘플을 분석하는 동안, 생존 CD34 + 세포 및 생존 CD45 + 세포의 농도 및 생존 CD45 + 세포 집단에서 생존 CD34 + 세포의 백분율이 계산됩니다.
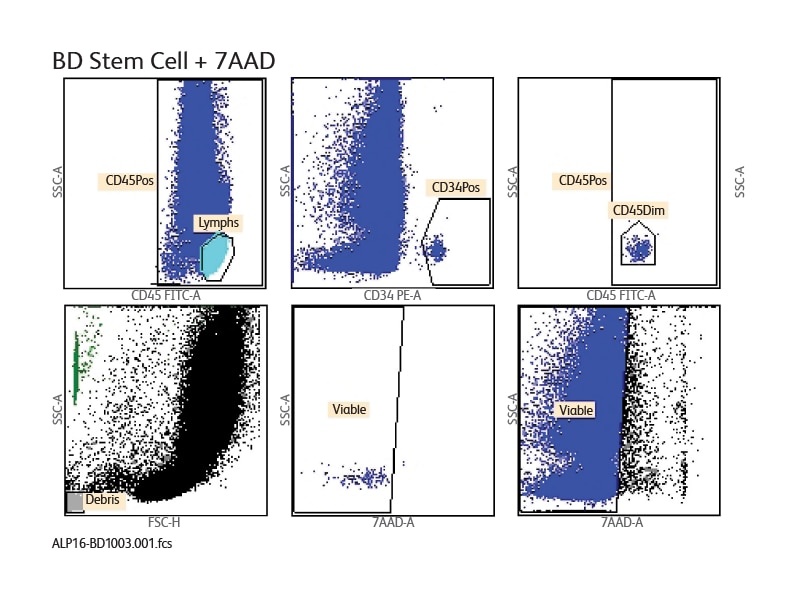
BD® Stem Cell Enumeration Assay를 이용하여 생성된 샘플 데이터
BD FACSCanto™ Flow Cytometer 에서 BD® Stem Cell Enumeration (SCE) Kit 를 이용하여 CD34+ 생존 가능 절대 계수를 열거하고 CD34+ 세포 백분율을 결정했습니다. BD FACSCanto™ II Flow Cytometer 에서 BD® Stem Cell Enumeration Kit를 이용한 샘플 검사실 보고서는 아래와 같습니다. 각 샘플에 대해 검사실 보고서가 작성되었으며 플롯, 분석 데이터 및 QC 메시지가 표시됩니다.
BD FACSCanto™ System과 함께 사용 가능한 BD® Cell Stem Enumeration Kit는 BD Trucount™ Absolute Counting Beads의 정밀성과 ISHAGE-기반의 표준화되고 정확한 결과를 위한 프로토콜 가이드라인을 통합했습니다.
참고문헌
- Doulatov S, Notta F, Laurenti E, Dick JE. Hematopoiesis: A human perspective. Cell Stem Cell. 2012;10(2):120-136. doi: 10.1016/j.stem.2012.01.006
- Jansen J, Hanks S, Thompson JM, Dugan MJ, Akard LP. Transplantation of hematopoietic stem cells from the peripheral blood. J Cell Mol Med. 2005;9(1):37-50. doi: 10.1111/j.1582-4934.2005.tb00335.x
- Karpova D, Rettig MP, DiPersio JF. Mobilized peripheral blood: an updated perspective. F1000Res. 2019;8:F1000 Faculty Rev-2125. doi: 10.12688/f1000research.21129.1x
- Schlossman SF, ed. Leucocyte Typing V: White Cell Differentiation Antigens. Oxford University Press; 1995. 1:840-846.
- Langermayer I, Weaver C, Buckner CD, et al. Engraftment of patients with lymphoid malignancies transplanted with autologous bone marrow, peripheral blood stem cells or both. Bone Marrow Transplant. 1995;15(2):241-246.
- Gajakowska A, Oldak T, Jastrzewska M, et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 2006;44(1):53-60.
- Sutherland DR, Anderson L, Keeney M, Nayar R, Chin-Yee I. The ISHAGE guidelines for CD34+ cell determination by flow cytometry. J Hematother. 1996;5(3):213-226. doi: 10.1089/scd.1.1996.5.213
BD® Stem Cell Enumeration (SCE) Kit는 CD34+ 절대 개수(cells/μL) 에서 생존 가능한 dual positive CD45+/CD34+ 조혈줄기세포 집단의 enumeration과 CD34+ (%CD34)인 총 생존 백혈구 개수의 백분율(%)을 동시에 제공합니다. 이 키트를 사용하여 정상 및 가동화된 말초 혈액, 신선 및 해동된 백혈구 분리 제품, 신선 및 해동된 골수, 신선 및 해동된 제대혈 등의 검체를 분석할 수 있습니다. 이 키트는 BD CellQuest ™ 또는 BD CellQuest ™ Pro 소프트웨어를 사용하는 BD FACSCalibur ™ Flow Cytometer 또는 BD FACSCanto ™ 임상 소프트웨어를 사용하는 BD FACSCanto ™ II Flow Cytometer 와 함께 체외 진단 (IVD) 용으로 사용됩니다.
BD 유세포 분석기는 1등급 레이저 제품입니다.