Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

수혈
수혈은 생명을 구하는데 중요합니다. 적시에 수혈을 하면 수술 중 또는 심각한 부상으로 인해 손실된 혈액을 보충할 수 있습니다. 혈우병 (hemophilia), 겸상적혈구빈혈(sickle-cell anemia) 또는 암과 같은 질환의 경우에도 수혈이 필요한 환자가 발생할 수 있습니다. 전 세계적으로 매년 헌혈을 통해 약 1 억 2 천만 단위의 혈액이 수집됩니다1 . 헌혈된 혈액은 수혈에 사용되기 전에 가공되고 검사를 진행합니다. 수혈은 일반적으로 안전하지만 의도하지 않은 전염이나 바이러스의 활성화 또는 이와 관련된 심각한 알레르기 반응의 발생과 같은 몇 가지 위험이 있습니다. 우리는 이러한 위험의 기초를 이해하는 데 큰 진전을 이루었으며 위험을 비켜갈 수 있는 방법을 찾았습니다.
수혈의 안전성을 위협하는 수혈 반응에는 어떠한 것들이 있습니까?
수혈은 일반적으로 안전하며 심각한 부작용을 일으키는 수혈보다는 적혈구 (RBC) 수혈이 더 성공적입니다.2 그러나 수혈은 인간 백혈구 항원 (human leukocyte antigen,HLA)에 대한 항체를 유도하여 면역억제를 유도하거나 cytomegalovirus (CMV)와 같은 바이러스를 전파할 수 있습니다. 발열성 비용혈성 수혈 반응 (febrile non-hemolytictransfusion reaction, FNHTR) 또는 혈소판 수혈 불응증 (platelet transfusion refractoriness)과 같은 수혈 반응은 백혈구 (또는 WBC) 항체에 의해 유발될 수 있습니다.3 혈액 및 혈소판 제제에 WBC가 존재한다는 것은 FNHTR발생률의 증가, CMV의 감염 및 수혈을 받는 사람의 HLA 항원에 대한 동종 면역과 관련이 있습니다.3 특정 수준 이하로 백혈구를 제거하는 것은 HLA 동종 면역을 예방할 수 있습니다 4 혈소판 및 적혈구 단위에서 99.9 % 이상의 백혈구를 제거하면 CMV의 잠재적 감염을 줄일 수 있습니다.5
백혈구 제거란 무엇이며 어떻게 이루어지나요?
백혈구 제거는 전혈 분획 또는 성분채집 후 얻은 적혈구 및 혈소판에서 백혈구를 제거하는 과정입니다. 원심 분리 또는 여과로 백혈구의 약 99.995 % 를 제거 할 수 있습니다.6 백혈구를 제거하기 위해 일반적으로 Buffy coat 방법과 전혈 여과 방법 (whole blood filtration method)이 사용됩니다. 백혈구 제거는 WBC 수를 단위당 5 x 106 이하로 낮추어 수혈과 관련된 합병증을 최소화할 수 있습니다.7,8 30 년 이상 동안 백혈구 제거가 표준 작업이 되었으며 수혈로 인한 부작용을 줄이기 위해 전세계적으로 채택되었습니다.9 미국, 캐나다 및 유럽에서 혈액 제제의 수혈과 관련된 위험을 완화하기 위해 전 혈액제제의 백혈구 제거를 수행하는 지침이 발표되었습니다. 미국에서는 수혈 전에 WBC 수가 단위당 5 x 106 이하인 경우만 허용됩니다.
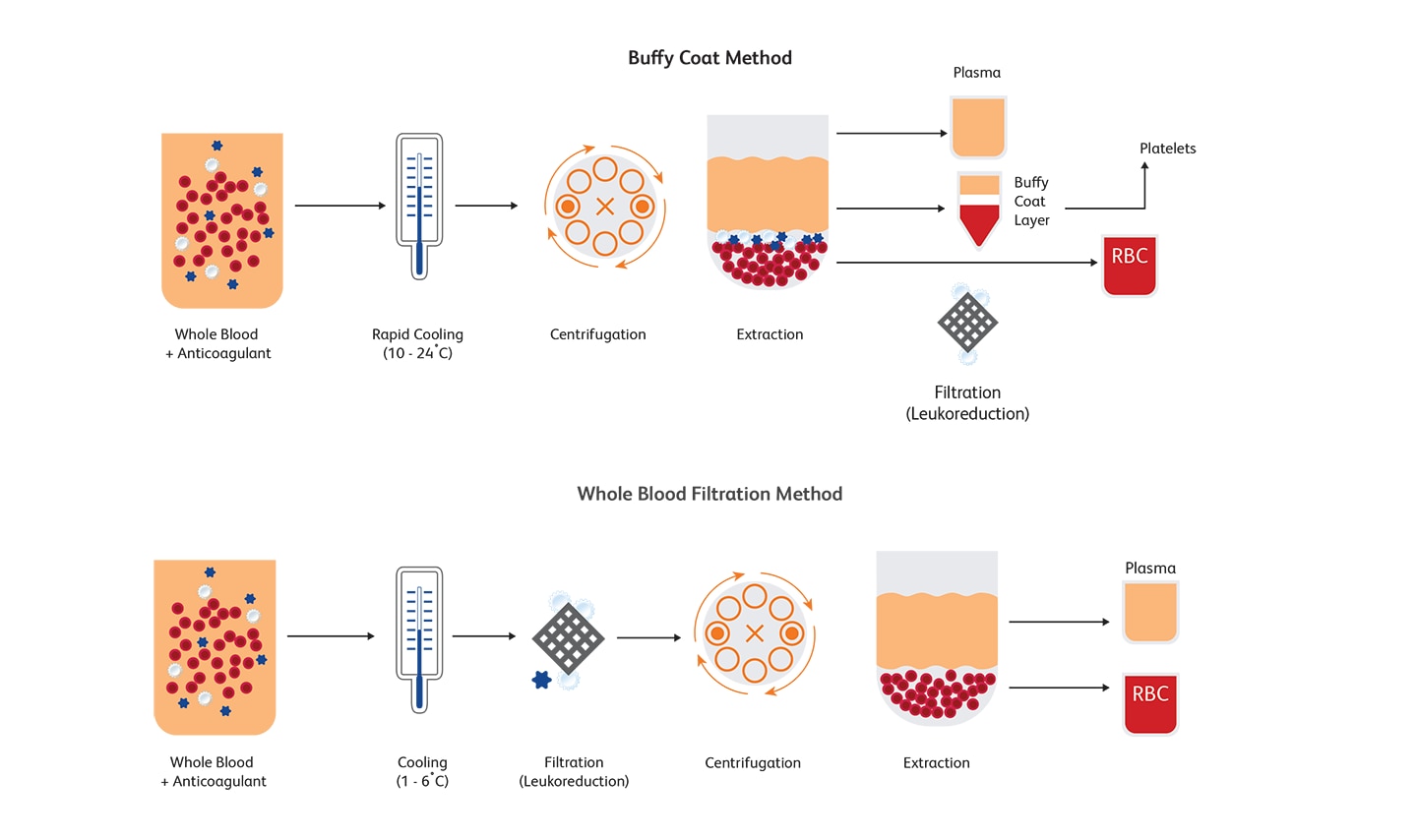
잔여 백혈구의 유세포 분석 검사
백혈구 제거 혈액 제제의 잔여 백혈구를 측정하는 것은 혈액 성분의 품질을 보장하는 데 중요합니다. 마찬가지로 신뢰할 수 있는 품질 관리 프로세스를 설정하는 것도 중요합니다. 백혈구 제거 후 혈액 내 잔여 백혈구 수를 측정하는 몇 가지 방법이 있습니다. 유세포분석과 Nageotte chamber를 사용하여 manual 카운팅 방법, 자동 백혈구 측정 장비를 사용하는 방법은 잘 알려진 방법들입니다. 유세포 분석은 백혈구 제거 혈액 제제를 평가를 위한 효과적이고 FDA 승인이 완료된 방법입니다.7 잔여 백혈구 계수에 사용되는 다양한 방법의 성능을 평가한 비교 결과를 보면 유세포분석법이 Nageotte 혈구 측정법에 비해 정확도 측면에서 우수하다는 것을 알 수 있습니다.8 유세포 분석은 정확성(accuracy), 정밀도(precision), 선형성(linearity) 및 견고성 계수 (robustness counting)에 대해서도 검증되었습니다.10
참고문헌
- World Health Organization. https://www.who.int/health-topics/blood-transfusion-safety#tab=tab_1. Accessed September 29, 2020.
- Silliman CC, Burke T, Kelher MR. The accumulation of lipids and proteins during red blood cell storage: the roles of leukoreduction and experimental filtration. Blood Transfus. 2017;15(2):131-136. doi: 10.2450/2017.0314-16
- Bianchi M, Vaglio S, Pupella S, et al. Leucoreduction of blood components: an effective way to increase blood safety? Blood Transfus. 2016;14(3):214-227. doi: 10.2450/2015.0154-15
- Sniecinski I, O’Donnell MR, Hill LR. Prevention of refractoriness and HLA-alloimmunization using filtered blood products. Blood. 1988;71(5):1402-1407.
- de Graan-Hentzen YC, Gratama JW, Mudde GC, et al. Prevention of primary cytomegalovirus infection in patients with hematologic malignancies by intensive white cell depletion of blood products. Transfusion. 1989;29(9):757-760. doi: 10.1046/j.1537-2995.1989.29990070177.x
- Shapiro MJ. To filter blood or universal leukoreduction: what is the answer? Crit Care. 2004;8(Suppl 2):S27-S30. doi: 10.1186/cc2453
- Dumont LJ, Dzik WH, Rebulla P, Brandwein H. Practical guidelines for process validation and process control of white cell-reduced blood components: report of the Biomedical Excellence for Safer Transfusion (BEST) Working Party of the International Society of Blood Transfusion (ISBT). Transfusion. 1996;36(1):11-20. doi: 10.1046/j.1537-2995.1996.36196190510.x
- Dzik S, Moroff G, Dumont L. A multicenter study evaluating three methods for counting residual WBCs in WBC-reduced blood components: Nageotte hemocytometry, flow cytometry and microfluorometry. Transfusion. 2000;40(5):513-520. doi: 10.1046/j.1537-2995.2000.40050513.
- Silliman C, Burke T, K, Kelher MR. The accumulation of lips and proteins during red blood cell storage: the roles of leukoreduction and experimental filtration. Blood Transfus 2017;15:131-6. DOI 10.2450/2017.0314-16
- Categnaro S, Dragone P, Chieregato K, Alghisi A, Rodeghiero F, Astori G. Enumeration of residual white blood cells in leukoreduced blood products: Comparing flow cytometry with a portable microscopic cell counter. Transfus Apher Sci. 2016;54(2):266-270. doi: 10.1016/j.transci.2015.10.001
BD Biosciences는 백혈구 제거 혈액 제제의 잔여 백혈구를 측정하기 위한 유세포 분석 장비 및 시약을 제공합니다.
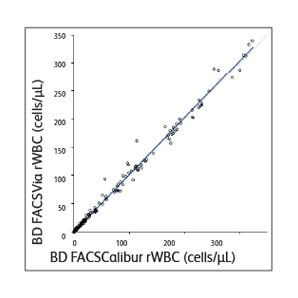
BD Leucocount ™ 키트는 BD Leucocount ™ 시약 및 BD Trucount ™ 튜브로 구성됩니다. BD Leucocount ™ 시약에는 PI (propidium iodide)가 포함되어 있습니다. PI는 RNase와 함께 사용할 때 세포 DNA 만 염색하는 핵산 dye입니다. 백혈구는 DNA를 포함하는 유핵 세포이므로 이 dye로 염색됩니다. 핵이 없는 입자 (혈소판 및 적혈구 포함)는 이 시약으로 염색되지 않습니다. BD Trucount ™ 튜브에는 단일 튜브에서 잔여 백혈구 (rWBC)의 절대 개수를 정확하게 측정하기 위한 내부 기준 역할을 하는 비드가 들어 있습니다. 백혈구 제거 적혈구 또는 혈소판은 염색 전에 BD Trucount ™ 튜브에서 동결 건조된 비드와 결합됩니다. rWBC 염색 후, 유세포 분석기에서 측정합니다. rWBC 수는 비드 수와 샘플 부피를 기반으로 한 간단한 계산식을 사용하여 결정됩니다. BD FACSVia ™ 및 BD FACSCalibur ™ 유세포 분석기의 정확성을 비교한 결과 백혈구 제거 적혈구 및 혈소판에 대한 WBC 수의 결과가 동등한 것으로 나타났습니다.11
BD Leucocount™ Kit으로 측정한 샘플 data
BD Biosciences leukoreduction 제품을 확인해보세요.
참고문헌
- Zeng Y, Dabay M, George V, et al. Comparison of flow cytometric methods for the enumeration of residual leucocytes in leucoreduced blood products: A multicenter study. Cytometry A. 2018;93(4):420-426. doi: 10.1002/cyto.a.23318
BD Leucocount ™ 키트는 BD Leucocount ™ 시약 (propidium iodide fluorescent dye) 및 BD Trucount ™ 튜브로 구성되어 있으며 백혈구 제거 혈액 제제의 잔여 백혈구 (rWBC)를 측정하기 위해 BD FACSCalibur ™, BD FACSort ™, BD FACScan ™ 및 BD FACSVia ™ 유세포 분석기 시스템 또는 FL2를 threshold 값으로 지정할 수 있는 488nm argon ion laser 가 장착된 유세포 분석기를 사용합니다. 체외 진단용입니다.