Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

세포 내 유세포분석
세포 내 유세포 분석은 세포 유형을 식별하고 세포주 및 이종 세포 샘플 내에서 신호 및 기능적 반응을 분석하는 강력한 기술입니다. Th17 및 regulatory T cell(Treg) 등 일부 유형의 세포에서 명확한 식별은 cytokine 또는 transcription factor 등 세포 내 marker의 조합에 따라 달라집니다. 또한 세포 내 유세포 분석은 세포 기능 및 신호 반응에 관한 풍부한 정보를 제공합니다. 세포 표면 marker에 특이적인 형광 항체를 세포 apoptosis, 세포 증식, 단백질 인산화의 marker와 결합하여 다양한 자극 또는 치료에 반응하는 세포 subset을 결정할 수 있습니다. 여러 Marker를 함께 사용하면 세포 당 더 많은 parameter를 측정할 수 있으므로 데이터 수집 시간이 단축되고 귀중한 샘플을 보존할 수 있습니다. Western blotting 및 기타 방법은 전체 세포 집단에 의해 발현되는 단일 단백질을 검사하는데 유용하지만 유세포 분석을 이용하면 개별 세포 수준에서 동시에 여러 단백질을 측정할 수 있습니다.
BD Biosciences는 fluorochrome 접합 항체, buffer, 키트 및 프로토콜을 제공하여 세포 내 유세포 분석을 용이하게 합니다. 당사의 항체는 생물학적으로 관련된 모델 시스템에서 테스트됩니다. 이렇게 확립된 도구는 면역학, 염증 및 줄기세포 생물학과 같은 분야에서 새로운 발견을 가능하게 합니다. BD fluorochrome-conjugated 항체, buffer, 키트 및 프로토콜을 포함하여 세포 내 cytokine 염색과 인 단백질 및 세포 내 유세포 분석을 통한 전사 인자 검출을 지원하는 도구와 기술을 찾아보십시오.
세포 내 염색의 기본 원리
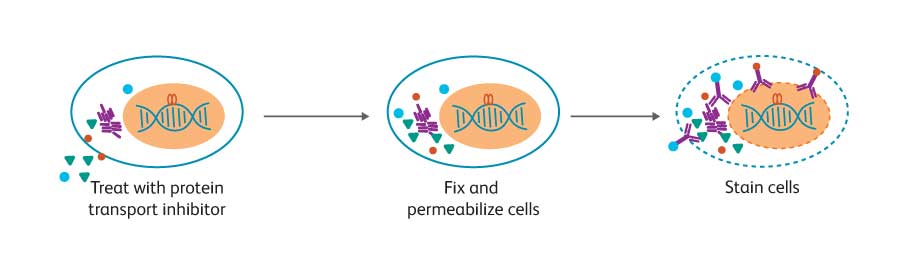
세포 표면 염색 기술은 상대적으로 표준 기술이지만 세포 내 marker에 대한 최적의 염색은 종종 표적 단백질의 생물학에 따라 달라집니다. 세포 내 단백질의 위치, 다른 분자와의 연관성 및 안정성에 따라 다른 세포 준비 및 염색 방법을 사용할 것을 권장하고 있습니다. 예를 들어 cytokine은 일반적으로 분비되는 단백질입니다.
그러나 cytokine이 세포 내부에 갇혀 있으면 BD GolgiStop ™ (Monensin 함유) 또는 BD GolgiPlug ™ (Brefeldin A 함유)와 같은 단백질 수송 억제제를 사용하여 세포내 단백질로 염색될 수 있습니다. Cytokine은 BD Cytofix/Cytoperm ™ Fixation and Permeabilization Solution 에서 제공하는 부드러운 고정 및 투과를 이용하면 상대적으로 접근 가능합니다.
Cytokine과 달리 전사 인자는 종종 핵 내부에 국한되어 DNA 및 기타 단백질에 결합됩니다. Stat5와 같은 일부 단백질의 인산화는 관심대상 인산화 된 에피토프를 가려서 보이지 않게 하는 이량체 형성을 초래합니다. 또한 세포 내 포스파타제는 이러한 단백질을 빠르게 탈 인산화 할 수 있습니다. 따라서 치료 후 세포를 신속하게 고정하고 더 강력한 투과성 조건을 적용하여 항체가 핵에 들어가서 파괴된 분자 복합체 내에서 에피토프에 접근할 수 있도록 해야 합니다.
세포를 고정 및 투과화 (dashed line 막으로 표시)하고 염색하고 유세포 분석으로 분석합니다. Cytokine 생산에 관한 연구를 위해 세포를 먼저 단백질 수송 억제제로 처리하여 세포 내부에 표적 단백질이 축적되도록 할 수 있습니다.
BD Biosciences는 세포 내 유세포 분석을 지원하는 도구를 제공합니다.
세포 내 유세포 분석 assays를 촉진하기 위해 BD는 여러 키트, buffer 및 프로토콜을 개발했습니다. 또한 시간, 샘플 및 비용을 절약하기 위해 주요 세포 표면 marker에 특이적인 많은 형광 항체가 여러 buffer 시스템에서 테스트되었습니다. Buffer는 다음에 사용할 수 있습니다.
Cytokine 측정
BD Cytofix/Cytoperm™ Fixation/Permeabilization Solution (Cat. No. 554722)은 대부분의 cytokine과 세포 표면 Marker를 염색하는 데 적합합니다. 이 buffer 시스템은 일부 전사 인자 및 기타 세포 내 단백질을 염색하는 데에도 사용할 수 있습니다. 이 buffer시스템에는 포름알데히드 기반 고정제와 함께 순한 detergent가 포함되어 있습니다.
전사인자
BD Pharmingen ™ Transcription Factor Buffer Set (Cat. No. 562574/562725)는 전사 인자만 염색하거나 세포 표면 marker 및 cytokine과 함께 염색하도록 설계되었습니다. 이 버퍼 시스템에는 포름알데히드 기반 고정제와 함께 순한 detergent가 포함되어 있습니다.
인산화 단백질 측정
BD Phosflow ™ Perm Buffer III (Cat. No. 558050)는 유세포 분석을 통한 포스포에피토프(phosphoepitope) 측정에 권장되는 투과 buffer입니다. Perm buffer III는 harsh 알코올 기반 buffer입니다. 특정 실험 요구 사항을 수용하기 위해 대체 투과 buffer도 사용할 수 있습니다. 또한 buffer 호환성 도구, 일반 클론에 대한 상세한 설명, BD Phosflow™ Buffer 프로토콜과의 호환성 을 제공합니다.
사용된 투과화 기술은 세포 표면 및 기타 세포 내 항원의 측정에 부정적인 영향을 미칠 수 있습니다. 핵에 접근하고 DNA/ 단백질 또는 단백질 / 단백질 복합체를 개방하는 동일한 기술은 종종 세포 표면 항원을 변성시켜 항체에 의한 측정을 방지할 수 있습니다. 다른 세포 내 단백질의 측정에는 다른 조건이 필요할 수 있지만 기본 원리는 동일합니다. 세포는 고정 및 투과된 다음 형광 항체로 세포 내에서 염색됩니다.
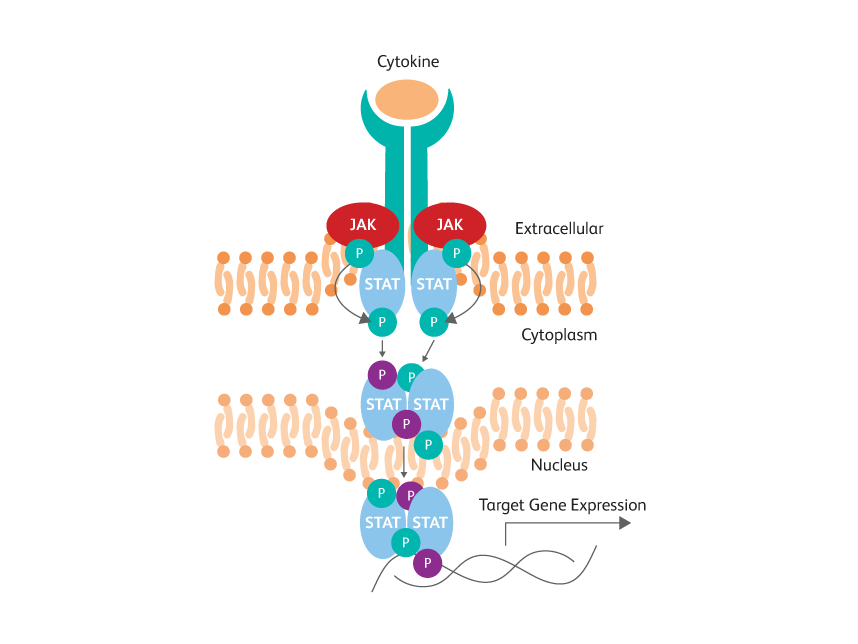
STAT 포스포티로신 에피토프는 활성화된 세포 내에서 이량체화에 의해 가려 보이지 않습니다.
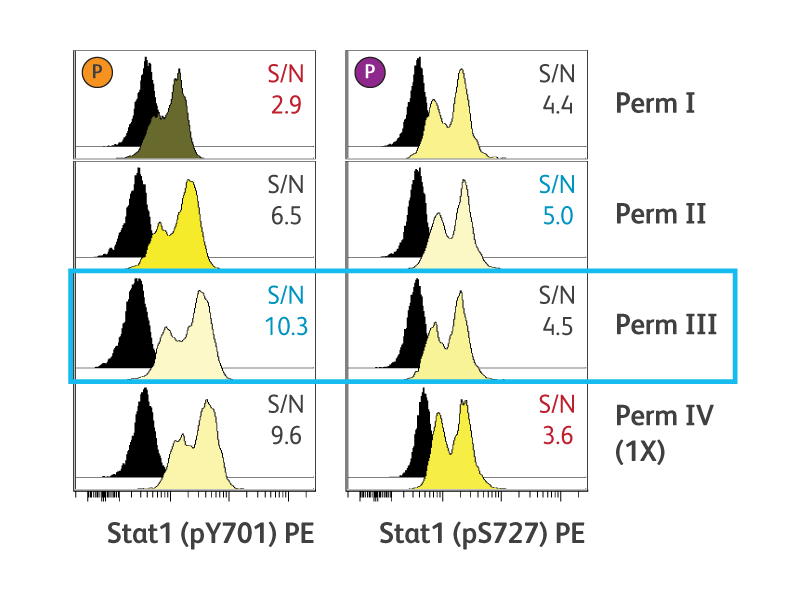
최적의 세포 투과성 조건은 에피토프 위치에 따라 다릅니다.
Cytokine 측정
다양한 활성화된 세포 유형은 면역 또는 염증 반응의 일부로 cytokine, chemokine 및 perforin 및 granzyme 같은 기타 염증 매개체를 분비할 수 있습니다.
ELISA 및 BD® Cytometric Bead Array (CBA)와 같은 방법은 전체 세포 집단에서 생성된 분비 단백질을 측정합니다. 대조적으로, 세포 내 유세포 분석은 관심있는 세포 집단 내에서 표현형으로 확인된 개별 세포 유형에 의해 생성된 cytokine 및 기타 염증 매개체의 분석을 가능하게 합니다.
세포 내 유세포 분석을 통해 활성화된 세포 집단에 의한 cytokine 생산이 다량의 cytokine 생산하는 소수의 세포 또는 세포 당 소량의 cytokine을 생산하는 많은 세포 집단의 결과인지 쉽게 확인할 수 있습니다. 또한 세포 내 유세포 분석을 통해 여러 cytokine을 동시에 측정하여 polyfunctional cell을 식별할 수 있습니다 .1 세포 내 cytokine 염색은 B cell 및 T cell 분화 및 가소성을 포함한 다양한 연구에도 유용하게 사용됩니다.
Cytokine은 일반적으로 분비된 단백질이기 때문에 먼저 단백질 수송 억제제를 사용하여 세포 내부에 포획되어야합니다. 가장 일반적으로 사용되는 두 가지 단백질 수송 억제제는 Monensin(BD GolgiStop ™ Inhibitor)과 Brefeldin A (BD GolgiPlug ™ Inhibitor)입니다. Monensin은 Golgi transmembrane Na ++/ H + 수송과 상호 작용하여 단백질 분비를 방지하고, brefeldin A는 cis / medial Golgi 복합체에서 세포 내 생성된 단백질을 소포체로 재분배합니다.2 결과적으로 단백질 수송 억제제의 최선의 선택은 cytokine 과 종에 따라 달라집니다(표 1).
| Species | Cytokines | Transport Inhibitor |
|---|---|---|
| Human | IL-1α, IL-6, IL-8, TNF-α | Monensin |
| Human | IFN-γ, IL-2, IL-10, IL-12, MCP-1, MCP-3, MIG, MIP-1α, RANTES | Either Monensin or Brefeldin A |
| Mouse | IL-6, IL-12, TNF-α | Brefeldin A |
| Mouse | GM-CSF, IL-3, IL-4, IL-5, IL-10 | Monensin |
| Mouse | IFN-γ, IL-2 | Either Monensin or Brefeldin A |
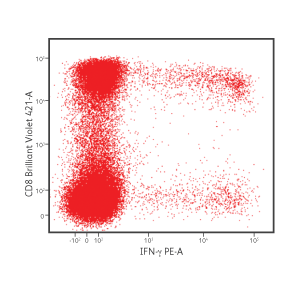
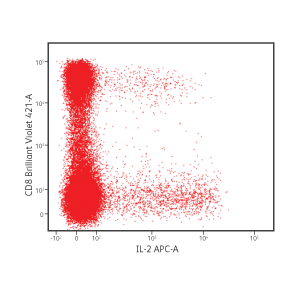
CD8 + 세포에서 IFN-γ 및 IL-2 생산.
PBMC는 brefeldin A의 존재하에 6 시간 동안 포도상 구균 장독소 B로 자극되었습니다. 자극 후, 세포는 BD Cytofix/ Cytoperm ™ Buffer System을 사용하여 고정 및 투과되었습니다. 세포는 다음 형광 항체로 염색되었습니다: CD3 FITC, CD4 PerCP-Cy5.5, CD8 BD Horizon Brilliant Violet ™ 421, IFN-γ PE 및 IL-2 APC. 그후 세포를 세척하고 BD FACSVerse ™ 유세포 분석기를 사용하여 분석했습니다.
BD Biosciences는 키트, buffer 시스템 및 풍부한 형광 항체 panel을 사용하여 cytokine 및 세포 표면 marker의 측정을 단순화했습니다. 다양한 형광 색소에 접합된 표면 Marker 및 cytokine에 대한 항체를 사용할 수 있습니다. 이를 통해 염색 panel 디자인의 유연성을 제공하여 고함량 multicolor 유세포 분석을 지원하여 귀중한 세포 샘플에서 대부분의 데이터를 얻을 수 있습니다.
BD FastImmune™ Kits 에는 테스트된 형광 항체 cocktail, 적절한 단백질 수송 억제제, 호환 가능한 buffer 및 전혈에서 cytokine 생성 세포의 최적 준비, 염색 및 측정을 위한 상세한 프로토콜이 포함되어 있습니다. BD FACSVerse ™ 유세포 분석기 시스템의 온보드 분석은 프로세스를 더욱 단순화합니다.
BD Cytofix/ Cytoperm ™ Buffer는 유세포 분석법에 의한 cytokine 생산 세포 분석은 수천 건의 간행물에서 인용되었습니다. 연구자들은 관심대상 cytokine 에 가장 적합한 단백질 수송 억제제를 선택하고 BD Cytofix/ Cytoperm ™ Buffer System을 사용하여 유세포 분석을 위해 세포를 고정, 투과 및 염색합니다.
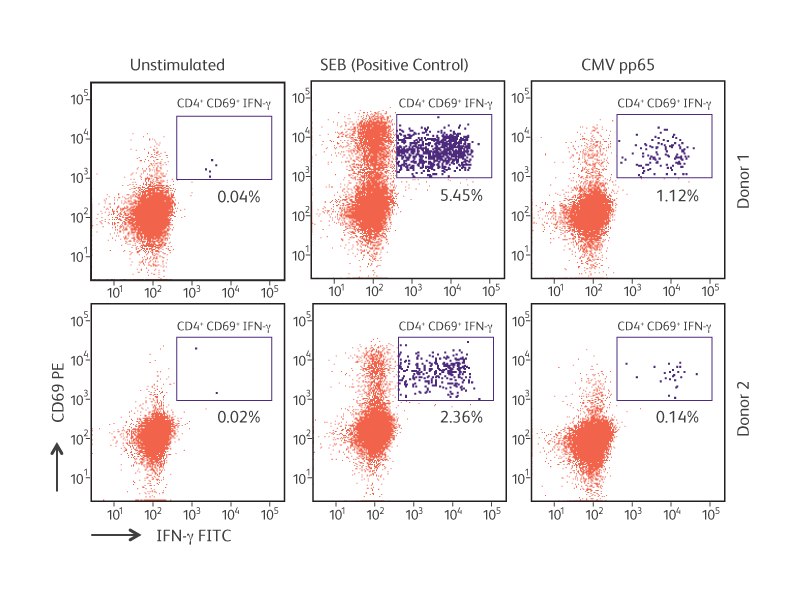
거대 세포 바이러스 (CMV) pp65 자극 CD4 + CD69 + T 림프구에 의한 항원 특이적 IFN-γ 생산.
참고문헌
- Seder RA, Darrah PA, Roederer M. T-cell quality in memory and protection: implications for vaccine design. Nat Rev Immunol. 2008;8(4):247-258. doi: 10.1038/nri2274
- Schuerwegh AJ, Stevens WJ, Bridts CH, De Clerck LS. Evaluation of monensin and brefeldin A for flow cytometric determination of interleukin-1 beta, interleukin-6, and tumor necrosis factoralpha in monocytes. Cytometry. 2001;46(3):172-176. doi: 10.1002/cyto.1102
전사인자
세포 내 유세포 분석을 통해 이종 세포 집단 내에서 전사 인자 및 관련 단백질을 측정할 수 있습니다.
여러 marker의 동시 분석을 통해 특정 분화 경로를 따라 이동하는 세포의 중요한 시점, marker 및 빈도를 결정할 수 있습니다.
전사 인자는 유전자 발현을 조절하기 위해 DNA 및 기타 단백질에 결합하는 단백질입니다. 그들은 세포 발달과 분화에 중요한 역할을 합니다. Treg 분화를 위한 FoxP3 및 최종 내배엽 분화를위한 Sox17이 있습니다.
FoxP3는 Tregs의 마스터 조절자로 간주됩니다. 많은 전사 인자와 마찬가지로 FoxP3는 수천 개의 유전자에 결합하여 Treg 기능에 필요한 유전자 발현을 upregulation 또는 downregulation하며 여기에는 IL-4 및 IFN-γ도 포함됩니다.4
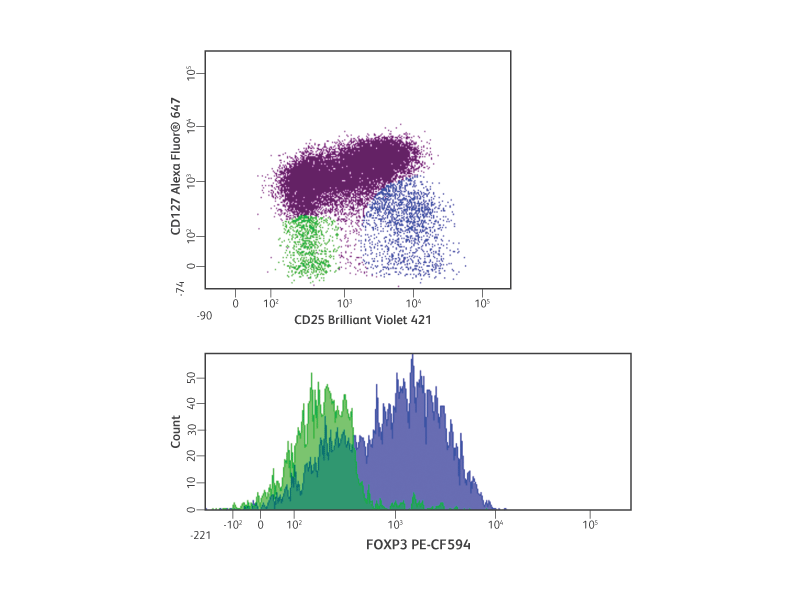
세포 내 유세포 분석에 의한 인간 Treg 측정
세포 내 cytokine 염색과 마찬가지로 유세포 분석을 사용한 전사 인자 검출에는 세포 고정 및 투과성이 필요합니다. 전사 인자는 일반적으로 DNA 및 기타 단백질에 결합된 핵에 위치합니다. 표적 분자 에피토프의 특성에 따라 다른 고정 및 투과 buffer가 필요할 수 있습니다.
세포의 고정 및 투과화는 세포 표면 marker 염색을 손상시킬 수 있으므로 호환되는 buffer의 선택이 더욱 중요합니다. 쉽게 전사 인자 검출을 가능하게 하기 위해 BD Biosciences는 BD Pharmingen™ Transcription Factor Buffer Set를 개발했습니다. 이 buffer는 세포를 충분히 투과시켜 핵내 에피토프의 노출을 허용하고 많은 세포 유형, 세포 표면 염색 및 tandem dyes 와 호환됩니다.
줄기세포 분화연구를 위한 편리한 키트
다능성 줄기세포가 다른 세포 유형으로 분화함에 따라 전사 인자 및 기타 단백질의 발현이 변경됩니다. 포유류 배아 발달에서 최종 내배엽은 간, 췌장 및 장을 생성합니다.5-7 최종 내배엽으로 지정하는 동안 전사 인자 Sox17 및 FoxA2 및 세포 표면 marker CD184 (CXCR4)의 수준이 증가하는 반면 Nanog 및 Sox2와 같은 다능성 marker는 감소합니다.2
Multicolor 유세포 분석은 관심있는 marker를 발현하는 세포의 상대적인 수를 결정하는 훌륭한 방법입니다. 이 방법은 세포 분화 경로의 연구, 특히 분화 프로토콜의 최적화, 정량화 및 서로 다른 프로토콜 및 세포 분화 잠재력 비교에 유용하게 사용됩니다.
줄기세포의 전사 인자 연구를 용이하게하기 위해 BD는 BD Stemflow ™ Human Pluripotent Stem Cell Transcription Factor Analysis Kit (Cat. No. 560589), BD를 포함하여 주요 줄기세포 특정 전사 인자의 측정을 위해 BD Stemflow™ Human Pluripotent Stem Cell Transcription Factor Analysis Kit (Cat. No. 560589), the BD Stemflow™ Mouse Pluripotent Stem Cell Transcription Factor Analysis Kit (Cat. No. 560585), the BD Stemflow™ Human Neural Cell Lineage Analysis Kit (Cat. No. 561526), the BD Stemflow™ Human Definitive and Pancreatic Endoderm Analysis Kit (Cat. No. 562496)를 포함한 여러 키트를 개발했습니다. 이 키트에는 다능성 줄기 세포를 특성화하고 다능성 줄기 세포의 각 계통으로의 분화를 추적하는 항체 및 buffer 시스템이 포함되어 있습니다.
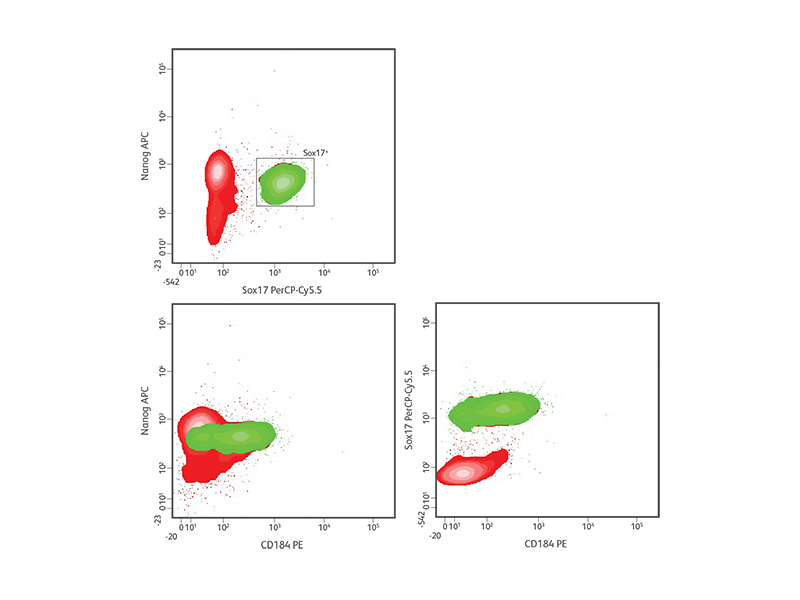
H9 hESC의 확실한 내배엽 분화.
참고문헌
- Birzele F, Fauti T, Stahl H, et al. Next-generation insights into regulatory T cells: expression profiling and FoxP3 occupancy in Human. Nucleic Acids Res. 2011;39(18):7946-7960. doi: 10.1093/nar/gkr444
- Beyer M, Thabet Y, Müller RU, et al. Repression of the genome organizer SATB1 in regulatory T cells is required for suppressive function and inhibition of effector differentiation. Nat Immunol. 2011;12(9):898-907. doi: 10.1038/ni.2084
- Wang P, McKnight KD, Wong DJ, et al. A molecular signature for purified definitive endoderm guides differentiation and isolation of endoderm from mouse and human embryonic stem cells. Stem Cells Dev. 2012;21(12):2273-2287. doi: 10.1089/scd.2011.0416
- Takayama K, Inamura M, Kawabata K, et al. Efficient and directive generation of two distinct endoderm lineages from human ESCs and iPSCs by differentiation stage-specific SOX17 transduction. PLoS One. 2011;6(7):e21780. doi: 10.1371/journal.pone.0021780
- Murry CE, Keller G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 2008;132(4):661-680. doi: 10.1016/j.cell.2008.02.008
- D’Amour KA, Agulnick AD, Eliazer S, Kelly OG, Kroon E, Baetge EE. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nat Biotechnol. 2005;23(12):1534-1541. doi: 10.1038/nbt1163
인산화
개별 세포 수준에서 데이터를 수집할 수 있는 기능을 통해 유세포 분석은 세포 신호 전달 연구에 몇 가지 이점을 제공합니다.
용해물 기반 접근법과 달리 유세포 분석은 이질적인 신호 반응의 측정 및 분석을 용이하게 합니다. 따라서, 작은 세포 집단 내에서 강력한 단백질 인산화 반응과 더 작지만 더 균질 한 반응을 구별하는 것이 가능합니다. 전혈과 같은 복잡한 세포 혼합물 내의 세포 subset에 세포 표면 Marker에 특이적인 형광 항체를 추가하면 단백질 인산화에 의해 매개되는 신호 반응을 감지할 수 있습니다. 더욱이, rare cell 집단은 pre-enrichment를 하지 않아도 측정할 수 있습니다. 결과적으로 제한된 세포 샘플에서 풍부한 데이터를 얻을 수 있습니다.
BD Phosflow ™ 제품은 세포 내 신호 분자의 유세포 분석 및 특정 posttranslational 변형에 최적화된 버퍼 및 형광 monoclonal antibodies 시스템으로 구성됩니다. 유세포 분석법으로 특정 인산화 된 에피토프를 측정하기 위해, 세포는 신호 단백질의 인산화된 상태를 유지하도록 고정된 다음 항체가 세포에 들어가고 표적 단백질에 특이적으로 결합할 수 있도록 투과됩니다. 염색된 세포의 유세포 분석은 세포 내 신호 전달 및 단백질 인산화의 스냅샷을 캡처 할 수 있습니다.
단백질 인산화는 본질적으로 일시적이며 단백질 포스파타제에 의해 크게 조절됩니다. 웨스턴 블롯 분석을 포함하여 대부분의 인 단백질 측정 방법은 적절한 자극 시점과 포스파타제의 신속한 비활성화가 필요로 합니다. 마찬가지로, 유세포 분석을 위한 세포 샘플은 포스포에피토프를 유지하기 위해 신속하게 고정되어야 합니다. 또 다른 중요한 고려사항은 인 단백질 발현 수준입니다. 특정 단백질 인산화 이벤트는 특히 세포가 낮은 수준의 특정 신호 단백질을 발현하거나 관심 부위의 불완전한 인산화를 나타내는 경우 single cell 수준에서 측정하기 어려울 수 있습니다. BD는 밝은 형광 색소에 직접 결합된 고품질 항체를 제공하여 인 단백질의 세포 내 측정을 크게 향상시킵니다.
Multiparameter flow cytometry는 복잡한 혼합물에서 세포 및 세포 subsets 내의 세포 내 신호 전달을 탐지하고 분석하는 데 주요 이점을 제공합니다. 세포 신호 연구는 종종 자극 또는 억제 분자를 사용한 치료에 대한 세포 반응을 조사하기 때문에, 자극되지 않거나 처리되지 않은 세포는 종종 배경 염색을 평가하기위한 최상의 control을 제공합니다. 면역 글로불린 아이소 타입 control과 달리, 자극되지 않은 세포 control은 각 항체의 고유한 배경 특성과 관심 세포 내 기본인 단백질 발현 수준을 설명합니다. 인산화된 에피토프를 노출하려면 세포 투과성이 필요합니다. 여러 buffer 시스템을 사용할 수 있지만 대부분 응용분야에서 BD Phosflow ™ Perm Buffer III이 권장됩니다. BD Biosciences 웹 사이트에 다양한 buffer 조건 및 염색 프로토콜에서 다양한 BD 세포 표면 marker 및 세포 내 항체의 성능에 대한 유용한 정보가게시되어 있습니다.
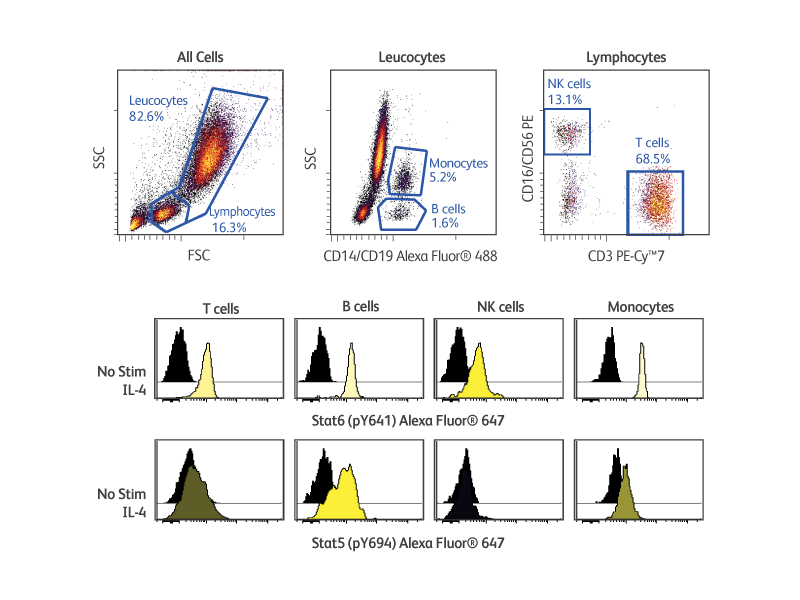
BD Phosflow ™ Kits는 적응 및 선천 면역 시스템의 세포에 의해 유도되는 신호 반응을 분석하는 데 유용한 도구를 제공합니다. 이 키트에는 특정 백혈구 subset를 식별하는 세포 표면 marker에 특이적인 형광 항체 칵테일과 주요 인 단백질에 대한 형광 항체가 포함됩니다. 또한이 키트는 호환 가능한 buffer, positive 및 negative control 세포, 세부 프로토콜을 제공합니다. BD Phosflow ™ Human Monocyte/NK Cell Activation Kit (Cat. No. 562089)를 사용하면 인간 전혈의 B 세포, T 세포, 단핵구 및 NK 세포에서 단백질 인산화를 동시에 연구 할 수 있으며, BD Phosflow™ Human T-Cell Activation Kit (Cat. No. 560750)는 CD4 대 CD8 T 세포에서 인 단백질 반응 연구에 유용하게 사용됩니다.
Multiplexing
다른 기술은 cytokine, 전사 인자 또는 인산화 단백질을 개별적으로 측정할 수 있지만, 세포 내 유세포 분석을 통해 단일 세포 수준에서 여러 세포 내 marker를 동시에 측정할 수 있습니다.
이 방법은 신호 응답, 분화 상태 및 기타 셀룰러 이벤트에 대한 데이터를 제공합니다. 세포 표면 및 세포 내 marker에 특이적인 형광 항체를 함께 사용하면 샘플 전반에 걸쳐 여러 세포 유형 내에서 표현형 및 기능적 차이에 대한 고해상도 비교 분석이 가능합니다.
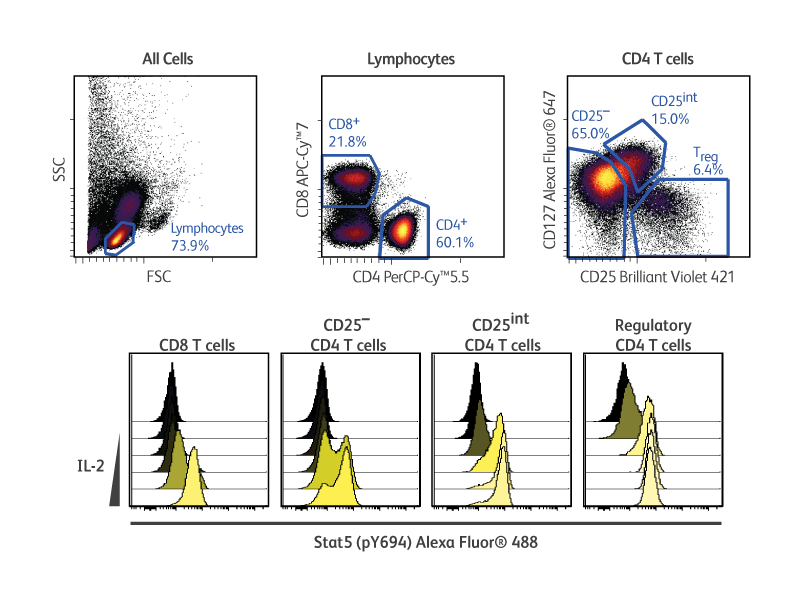
제시된 예에서, cryopreserved PBMC는 표면 및 세포 내 marker로 고정, 투과 및 염색하기 전에 농도를 증가시키며 재조합 IL-2로 자극했습니다. BD Pharmingen ™ Transcription Factor Phospho Buffer Set의 사용은 IL-2에 대한 반응으로 regulatory T cell에서 인산화 된 STAT5와 전사 인자 FoxP3을 동시에 측정할할 수 있었습니다.
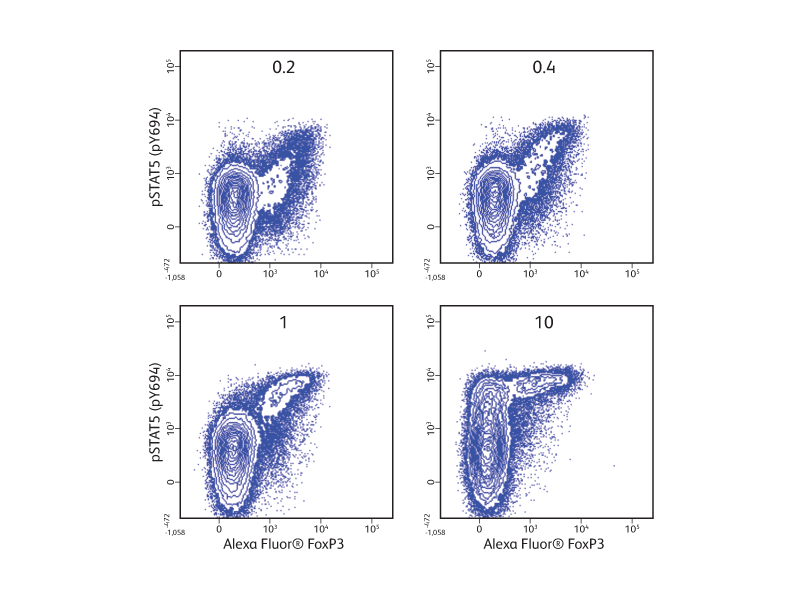
T-cell subset 에서 IL-2의 용량-반응.
동일한 샘플 내의 세포에 의한 다중 전사 인자, cytokine및 표면 marker의 발현 수준을 동시에 측정하는 것은 T helper (Th) cell 분화 및 기능 연구에 매우 유용합니다. RORγt는 Th17 세포의 대표적인 전사 인자입니다. IL-17 분비와 CD4 + CD8 + double-positive 흉선 세포의 유지에 중요합니다.1,2
표시된 실험 결과에서 세포는 BALB/c 마우스 흉선 및 비장에서 분리되었습니다. 흉선 세포 또는 비장 세포는 CD44, CD62L, CD196 또는 적절한 면역 글로불린 아이소 타입 control에 특이적인 형광 항체로 표면 염색되었습니다. 세포를 BD Pharmingen ™ Transcription Factor Buffer Set 로 고정하고 투과시킨 다음 RORγt, Foxp3, IL-17A 및 IFN-γ에 특이적인 형광 항체로 세포 내 염색했습니다.
상단 패널에서 IL-17A의 세포 발현은 RORγt, Foxp3 (Treg 전사 인자) 및 IFN-γ (Th1 cytokine)의 발현과 비교됩니다. 흉선 세포에서 예상한 바와 같이 IL-17A + RORγt + double-positive세포가 많았지만 본질적으로 Foxp3 또는 IFN-γ와 IL-17A의 공동 발현은 없었습니다. 비장 세포는 IL-17A가 거의 발현되지 않았습니다.
하단 panel의 추가 분석에 따르면 비장에서 IL-17A를 생성하는 세포는 표면 marker CD44 및 CD196 (CCR6)을 발현했지만 CD62L은 발현하지 않았으며 IL-17A+세포의 표현형에 대한 추가 정보를 제공했습니다.
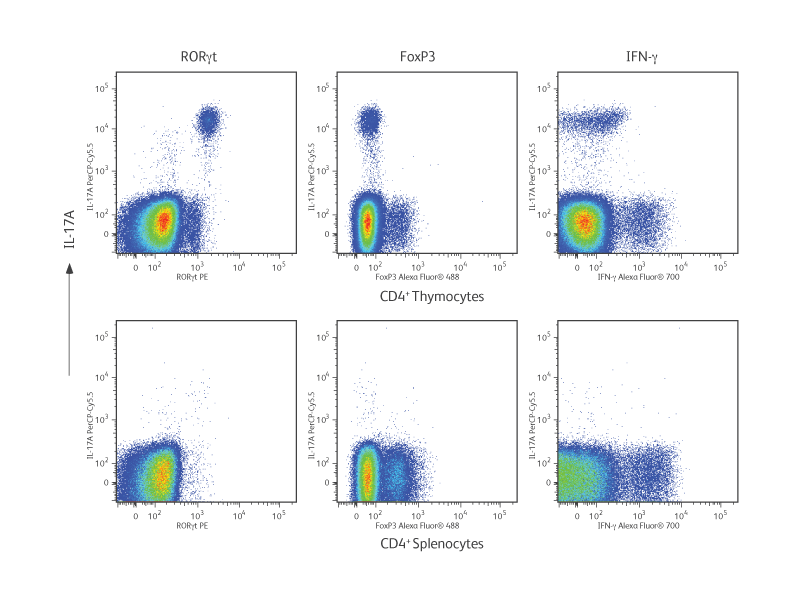
BALB/c 흉선 및 비장에서 나온 Th17 cell의 표현형 분석.
참고문헌
- Ghoreschi K, Laurence A, Yang XP, Hirahara K, O’Shea JJ. T helper 17 cell heterogeneity and pathogenicity in autoimmune disease. Trends Immunol. 2011;32(9):395-401. doi: 10.1016/j.it.2011.06.007
- Ivanov II, McKenzie BS, Zhou L, et al. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell. 2006;126(6):1121-1133. doi: 10.1016/j.cell.2006.07.035
-
브로셔
-
Frequently Asked Questions
-
제품정보시트
-
BD Pharmingen™ Transcription Factor Buffer Set
-
BD Pharmingen™ Transcription Factor PhosphoPlus Buffer Set
-
BD FACSelect™ Buffer Compatibility Resource
-
BD Phosflow™ Human CrkL (pY207) Monoclonal Antibodies
-
BD Phosflow™ Human Monocyte/NK Cell Activation Kit
-
BD Phosflow™ Smad Monoclonal Antibodies
-
BD Phosflow™ T Cell Activation Kit (Human)
-
프로토콜
-
96 Deep-Well BD Phosflow™ Staining with Cytokine Stimulation
-
BD Phosflow™ 96-Well Deep-Well Plate Protocol
-
BD Phosflow™ Alternative Protocol 1: Fix–Stain–Perm
-
BD Phosflow™ Alternative Protocol 2: Stain–Fix–Perm
-
BD Phosflow™ Protocol for Adherent Cells
-
BD Phosflow™ Protocols for Human PBMCs
-
BD Phosflow™ Protocols for Human Whole Blood Samples
-
BD Phosflow™ Protocols for Mouse Splenocytes or Thymocytes
-
BD Phosflow™ Protocols for TCR Stimulation: Human
-
Live Cell Discrimination and Simultaneous Measurement of Phosphorylation and Cell Surface Markers in Thawed and Activated Human PBMCs Using BD Horizon™ Fixable Viability Stain 450, BD Cytofix™ Fixation Buffer and BD Phosflow™ Perm Buffer III
-
Simultaneous Measurement of Cell Surface Markers with Cellular Proliferation and Protein Phosphorylation
-
Simultaneous Measurement of Cell Surface Markers with T-bet and Stat5 (pY694) in IL-2–Stimulated Human Whole Blood using BD Phosflow™ Lyse/Fix Buffer and BD Phosflow™ Perm Buffer III
-
Suggested Stimulation Conditions for Phosphoprotein Detection
-
도구
-
웨비나
연구용입니다. 진단용 또는 치료용으로 사용할 수 없습니다.
Alexa Fluor는 Life Technologies Corporation의 상표입니다.
CF는 Biotium, Inc.의 상표입니다.
Cy는 Global Life Sciences Solutions Germany GmbH 또는 Cytiva로 사업을 수행하는 계열사의 상표입니다. Cytobank는 Beckman Coulter, Inc.의 상표입니다.