Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

백혈병
백혈병에서 통제되지 않은 확장을 겪는 미성숙 또는 비정상 세포는 백혈구의 과잉생산을 초래하고, 충분한 적혈구와 혈소판이 생성되지 못하도록 하는 경우도 있습니다. 급성 백혈병의 경우 세포가 여전히 증식중이지만 최종 분화로 이동하지 않은 단계에서 정상적인 세포 분화 경로가 차단됩니다. 2018 GLOBOCAN 조사에 따르면 전 세계적으로 백혈병 환자가 증가하고 있습니다. 신규 등록된 백혈병 환자는 437,033명으로 전세계 발병률은 5.2, 사망률은 3.5(100,000당 ASR)를 기록했습니다.1 골수에 있는 전구세포에 따라 백혈병은 림프구성 또는 골수구성으로 구분됩니다. 림프구성(림프 모세포) 백혈병은 T 또는 B 림프구성 선조에서 발생하는 반면 비림프구성 또는 골수성 백혈병은 적혈구, 과립구, 단핵구, 또는 혈소판의 선조로부터 발생합니다.1
백혈병의 원인?
백혈병은 골수에 있는 림프구 또는 골수 선조의 유전적 및 대사적 변화로 발생합니다. 백혈병과 관련한 환경 및 생활습관 위험 요소에는 흡연, 실내 및 실외 대기 오염, 방사선 및 특정 화학물질 노출, 방사선 치료, 화학요법 및 다운증후군 등의 유전질환이 포함됩니다.2
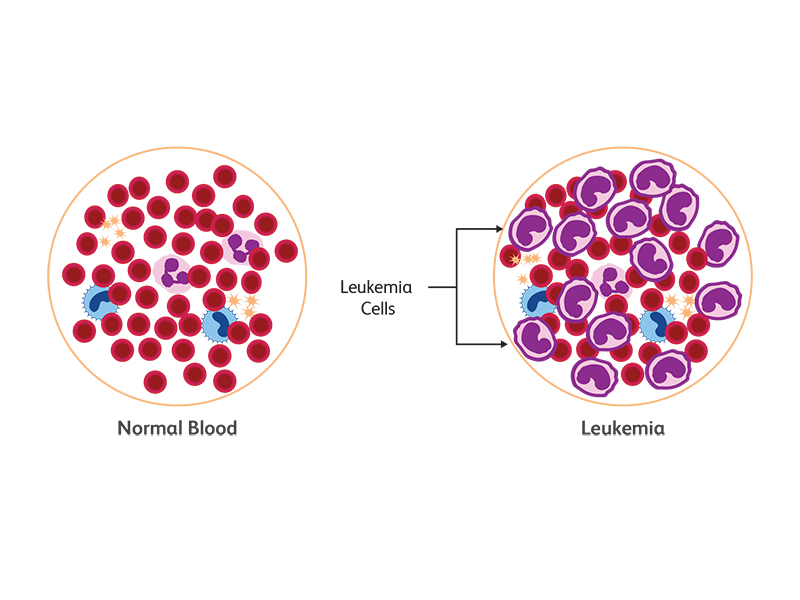
백혈병 유형
백혈병은 백혈병 세포의 증식속도에 따라 급성 또는 만성으로 분류됩니다. 백혈병에는 네 가지 주요 유형이 있습니다. 우세한 세포 계통에 따라 만성/급성 골수성 백혈병(CML 및 AML), 만성/급성 림프구성 백혈병(CLL, ALL)로 나뉩니다.3 미국에서 암 및 백혈병 발병 건수가 증가하고 있습니다. 20년 동안(1998년~2018년) CLL의 경우 187 %, AML의 경우 108 %, CML의 경우 96 %, ALL의 경우 92 % 증가를 보이며 모든 유형의 백혈병 건수가 증가했습니다. 1,4
백혈병은 어떻게 진단되나요?
백혈병은 복잡한 다인성 질환이며 백혈병 진단을 위해서는 증상의 검토, 신체검사, 혈액검사, 골수 생검, 뇌척수액(CSF) 평가, 방사선, 유전자 검사를 포함한 여러 분야의 검사가 필요합니다. 유세포분석은 백혈병 진단에 필수적인 중요한 도구라는 점이 입증되었습니다.
ZAP-70및 CD38와 같은 특정 marker를 사용한 유세포 분석을 통해 말초 백혈병의 세포표현형을 분석하여 백혈병 유형을 결정할 수도 있습니다.5 수많은 mononuclear cell 또는 비정형 침윤을 나타내는 뇌척수액(CFS)의 유세포 분석은 백혈병의 골수 외 확산과 CNS와의 관련성을 나타냅니다.5,6
백혈병을 위한 유세포 분석 기반 assay
유세포 분석은 질병의 진단 및 모니터링에서 귀중한 tool로 보고되고 있습니다.5
모세포 population 찾기
유세포 분석은 골수성 및 림프성 모세포를 구분하기 위한 일반적인 방법을 제공합니다.5
- 모세포 또는 미성숙세포 식별: SSC dot plot에서 CD34의 양성 발현과 CD45(CD45 low) 의 강도가 낮은 것으로 보통 식별되는 미성숙 세포 또는 모세포
- 비정상적인 모세포: 미성숙 세포에서 비정상적인 항원의 발현은 백혈병 가능성에 대한 추가 조사가 필요하다는 것을 의미합니다. 이러한 비정상적인 상태에는 arrested 성숙, 다른 계통의 항원 발현 (예: 골수 세포상의 CD19, CD7 림프 마커)7, 항원의 asynchronous 발현 (예: CD34 모세포에서 CD15 성숙 호중구 marker 발현) 7, 정상 항원 발현의 비정상적 강도 (예: T-ALL에서 낮은 CD3 발현, B-ALL에서 CD20 발현이 저조하거나, 발현되지 않음)이 포함됩니다.5
백혈병 확인: 급성 백혈병
항상성 조건에서 골수 또는 말초 혈액의 모세포 수가 cell의 5% 미만입니다. 모세포 수의 증가는 우려할 만한 사안으로 추가적인 조사가 필요합니다. AML에서 모세포의 수와 표현형 차이가 관찰될 수 있습니다.
만성림프구성 백혈병 진단
CLL 진단은 형태학적 진단과 면역 표현형에 의존하고 있습니다. WHO의 진단 기준에 따르면 전형적인 CLL의 면역 표현형은 CD20 발현은 약하며 동시에 neoplastic B cell에서 CD5, CD19, CD23의 공동 발현이 나타나는 것으로 입증했습니다(3개월 동안 말초 혈액에서 5,000개의 circulating neoblasts/mL 수로 계산) .8 CD5, CD19, CD23, 약한 CD20 및 면역 글로불린 kappa/lambda 등의 marker는 일상적인 진단에서 사용되며 screening panel에서 필요한 것으로 간주됩니다. Neoplastic B cell을 더욱 잘 특성화하기 위한 정보를 제공하거나 약한 CD79b, CD81 또는 CD38, CD45와 같은 예후와 관련한 가치가 있기 때문에 다른 marker도 권장됩니다.8
만성 백혈병에서 잔류 질환 모니터링
유세포 분석은 만성 백혈병에서 잔류 질환을 측정할 수 있는 민감도가 높은 방법으로 보고되었습니다. 순차적인 gating 전략을 사용하면 CD5+, CD19+ CLL와 같은 multiple marker를 동시에 측정할 수 있습니다. 정상세포와 neoplastic 세포 간 marker .발현도 구별할 수 있습니다.8
골수성 모세포와 림프성 모세포의 구분
백혈병의 면역학적 특성에 대한 WHO및 유럽의 분류기준에서는 유세포 분석을 통해 백혈병 유형을 구분하는데 사용할 수 있는 특정 lineage marker를 제공하고 있습니다. 8 Myeloid blasts는 cytoplasmic myeloperoxidase (cyMPO) 및CD117 에 양성인 반면 lymphoid blasts 는 cytoplasmic CD79a (cyCD79a) 또는 cytoplasmic CD3 양성으로 확인할 수 있습니다.7
백혈병 sub-grouping
백혈병 sub-grouping에 사용되는 유세포 분석 panel은 조사대상 cell lineage에 따라 달라집니다.7
- B cell lineage 이상: To investigate B cell lineage을 조사하기 위해 CD5, CD10, CD19, CD20, CD45 및 immunoglobulin kappa, lambda를 결합한 항체 panel이 사용됩니다.8,9
- T cell lineage 및 NK cell 이상: T cells 및 NK cells은 림프증식성 질환의 15%를 차지합니다. T cell 및NK cell 항원 발현에 중복이 있습니다. T/NK cell neoplasms을 조사하기 위해 CD2, CD3, CD4, CD5, CD7, CD8이 포함된 항체 panel을 사용할 수 있습니다.9
- 말초 혈구수 증가: 말초 혈구수가 증가하면 CD19, flow cytometry screen이 권장됩니다.
- Myelomonocytic lineages평가: Myelomonocytic lineages 평가에 CD13, CD33, CD16, CD10, CD11b, CD14, CD64가 포함됩니다.10
- 항체이상: 비정상적인 항체 수준이 관찰되는 경우 CD19 및 CD56 marker 를 포함하는 형질세포 계통 검사 panel이 사용됩니다.11 이러한 이상상태에는 arrested maturation, 다른 계통의 항원 발현(예:골수 세포상 CD19, CD7 림프 marker), 항원의 asynchronous 발현(CD34 blast에 CD15 성숙 호중구 marker발현), 정상적인 항원 발현의 비정상적 강도(T-ALL에서 CD3 가 낮게 발현됨, B-ALL에서 CD20가 낮게 발현되거나 발현되지 않음) 이 포함됩니다. 비정상적인 CD5 발현은 CLL에서 보이고 비정상적인 CD10 발현은 여포성 림프종에서 관찰될 수 있습니다.12
- 유세포 분석은 질병 모니터링 및 미세잔존질환 평가에 있어 매우 가치 있음이 증명되었습니다.8
유세포분석 기반의 미세잔존질환(MRD) 평가
미세잔존질환(MRD) 은 치료 중 및 치료후 여전 환자가 적은 수의 백혈병 세포를 보유하는 상태를 말합니다. 이러한 세포는 향후 재발의 원인이 될 수 있기 때문에 치료용량 감소 또는 증가, 이식 적격여부 결정, 치료 결과를 알리는 등 치료 조정을 위해 MRD를 모니터링 하는 것은 필수적입니다. 급성 림프모구 백혈병 환자와 급성 골수성 백혈병 환자에서 MRD 평가를 위해 multicolor 유세포 분석을 이용한 prognostic utility가 확립되었습니다.13 MRD 음성 결과는 다발성 골수종에서 장기적으로 좋은 예후의 예측인자로 간주됩니다.14
유세포 분석은 백혈병 cell의 표현형 특성화를 촉진시키고 MRD 모니터링을 가능하게 합니다. 형광 표지된 monoclonal 항체를 polychromatic 유세포 분석에 사용하여 MRD 를 식별하는 marker panel을 실행할 수 있습니다.5,11 Fusion transcript amplification의 PCR 모니터링은 일부 환자에게만 관련되기 때문에 AML 환자의 MRD 모니터링 tool로 유세포 분석이 사용됩니다. 3~8색 범위 panel을 이용한 MRD 평가에서 표준화된 정량적 유세포 분석 프로토콜을 사용할 수 있습니다.13, 14 MRD값이 0.01% (골수흡인에서 1 MRD cell/10,000 골수세포)을 초과하면 재발 위험이 높고 생존율이 낮습니다.15 유세포 분석을 통해 형태학적으로 모호한 세포의 표현형과 기능을 동시에 설명할 수 있습니다.
BD Biosciences 는 백혈병과 관련된 면역집단 측정을 위한 유세포 분석 장비와 시약을 제공합니다.
당사의 광범위한 single-color 항체 CE-IVD시약 포트폴리오는 다양한 specificity 와 dye 를 아우르며 혈액 종양의 특성화에 도움을 줍니다. 이러한 panel은 검사실에서 검증 및 확인해야 합니다.
또한 BD Biosciences 는 백혈병 및 림프종 면역표현형 표준화에 도움을 주는 포괄적인 시약, setup bead, 프로토콜, assay template 으로 구성된 BD OneFlow™ Solution 을 제공합니다. 이를 통해 검사실 효율성을 개선하고 결과의 신뢰도와 정확성을 높일 수 있습니다 . 16,17
참고문헌
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [published correction appears in CA Cancer J Clin. 2020 Jul;70(4):313]. CA Cancer J Clin. 2018;68(6):394-424. doi:10.3322/caac.21492
- Filippini T, Heck JE, Malagoli C, Del Giovane C, Vinceti M. A review and meta-analysis of outdoor air pollution and risk of childhood leukemia. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. 2015;33(1):36-66. doi:10.1080/10590501.2015.100299
- Thapa B, Fazal S, Parsi M, Rogers HJ. Myeloproliferative Neoplasms. In: StatPearls. Treasure Island (FL): StatPearls Publishing; August 13, 2020.
- Hao T, Li-Talley M, Buck A, Chen W. An emerging trend of rapid increase of leukemia but not all cancers in the aging population in the United States. Sci Rep. 2019;9(1):12070. Published 2019 Aug 19. doi:10.1038/s41598-019-48445-1
- Wang XM. Advances and issues in flow cytometric detection of immunophenotypic changes and genomic rearrangements in acute pediatric leukaemia. Transl Pediatr. 2014;3(2):149-155. doi:10.3978/j.issn.2224-4336.2014.03.06
- Chauhan AF, Viruni N, Alvin Liu TY, Arevalo JF, Cheson BD. Successful treatment of ocular chronic lymphocytic leukaemia with Ibrutinib: case report and review of the literature. Leuk Res Rep. 2020;14:100200. doi:10.1016/j.lrr.2020.100200
- Matarraz S, Almeida J, Flores-Montero J, et al. Introduction to the diagnosis and classification of monocytic-lineage leukaemias by flow cytometry. Cytometry B Clin Cytom. 2017;92(3):218-227. doi:10.1002/cyto.b.21219
- Del Giudice I, Raponi S, Della Starza I, et al. Minimal residual disease in chronic lymphocytic leukaemia: a new goal? Front Oncol. 2019;9:689. doi:10.3389/fonc.2019.00689
- Seegmiller AC, Hsi ED, Craig FE. The current role of clinical flow cytometry in the evaluation of mature B-cell neoplasms. Cytometry B Clin Cytom. 2019;96(1):20-29. doi:10.1002/cyto.b.21756
- Bento LC, Correia RP, Pitangueiras Mangueira CL, et al. The use of flow cytometry in myelodysplastic syndromes: A review. Front Oncol. 2017;7:270. doi:10.3389/fonc.2017.00270
- Kumar S, Kimlinger T, Morice W. Immunophenotyping in multiple myeloma and related plasma cell disorders. Best Pract Res Clin Haematol. 2010;23(3):433-451. doi:10.1016/j.beha.2010.09.002
- Jaseb K, Purrahman D, Shahrabi S, Ghanavat M, Rezaeean H, Saki N. Prognostic significance of aberrant CD5 expression in B-cell leukaemia. Oncol Rev. 2019;13(1):400. doi:10.4081/oncol.2019.400
- Kern W, Bacher U, Haferlach C, Schnittger S, Haferlach T. The role of multiparameter flow cytometry for disease monitoring in AML. Best Pract Res Clin Haematol. 2010;23(3):379-390. doi: 10.1016/j.beha.2010.06.007
- Perrot A, Lauwers-Cances V, Corre J, et al. Minimal residual disease negativity using deep sequencing is a major prognostic factor in multiple myeloma. Blood. 2018;132(23):2456-2464. doi:10.1182/blood-2018-06-858613
- Kruse A, Abdel-Azim N, Kim HN, et al. Minimal residual disease detection in acute lymphoblastic leukaemia. Int J Mol Sci. 2020;21(3):1054. doi:10.3390/ijms21031054
- van der Velden VHJ, Flores-Montero J, Perez-Andres M, et al. Optimization and testing of dried antibody tube: The EuroFlow LST and PIDOT tubes as examples. J Immunol Methods. 2019;475:112287. doi: 10.1016/j.jim.2017.03.011
- Moloney E, Watson H, Barge D, et al. Efficiency and health economic evaluations of BD OneFlow™ Flow Cytometry Reagents for diagnosing chronic lymphoid leukaemia. Cytometry B Clin Cytom. 2019;96(6):514-520. doi: 10.1002/cyto.b.21779
BD OneFlow™ 제품과 BD single-color 항체 시약은 유럽 In Vitro Diagnostic Medical Device Directive 98/79/EC를 준수하여 CE 인증을 받았습니다.
체외진단용입니다.