Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current location or be switched to your location?

NK세포
NK cell은 일반적으로 선천적(innate) 면역 세포로 분류되지만 림프구와 형태적으로 유사하고 림프 마커의 발현과 같은 림프구의 특징을 가지고 있습니다. NK cell은 침입하는 병원체와 종양에 대해 최전선에서 방어하지만 T 림프구와 달리 특정 항원 인식이나 공동 자극이 필요하지 않습니다. NK cell은 T cell의 counterpart로써 선천성 림프세포 (ILC)의 일부이며 기능에 따라 3 개의 그룹 (그룹 1–3)으로 나눌 수 있습니다. NK cell은 선천성 림프세포 (ILC) Group I 에 속하며 CD8 + T cell과 유사한 세포 독성기능을 가지고 있습니다.1
NK 세포의 종류
NK cell은 골수에서 파생되지만 골수와 이차 림프 조직에서 모두 성숙할 수 있습니다. 인간의 경우 세포독성, 조절 프로파일 및 내성 등 각각 수행하는 기능에 따라 여러 종류의 NK cell (NK 세포 독성, NK 조절 및 NK 메모리)로 분류할 수 있습니다. 2각 유형의 NK cell은 분비되는 분자 및 표면/ 세포내 NK cell 마커로 구분될 수 있습니다. 이러한 NK cell마커는 NK cell을 모이게 하고 활성화시키는 외부 자극 등의 환경적 상황에 따라 다르게 발현됩니다. 표면 마커만으로는 NK 세포 유형을 분리할 수 없지만 대사에 관여하는 마커를 확인하면 어떠한 NK 세포가 관여하는지 알아낼 수 있습니다. NK 세포독성 cell은 해당 과정(glycolysis)과 산화적 인산화를 특징으로 합니다. NK regulatory cell은 에너지 생성을 위해 포도당 이외의 공급원을 사용하므로 해당과정과 산화적 인산화 수준이 낮습니다. NK memory cell은 활성산소종 (ROS)이 낮고, 포도당 및 지질 대사가 높습니다. 3
NK cell의 기능
바이러스 제어
NK cell은 HIV (NKG2C, NK p10, NK p46), HCV (NKG2D, perforin, granzyme B, 2B4), CMV (NKG2C, CD57, KIR) 및 EBV (NKG2A, NKG2D, CD16, 2B4)와 같은 특정 유형의 바이러스와 만나는 경우 분열하고 특정 분화를 거치며 다양한 receptor 및 신호 분자 set를 발현하게 됩니다. 또한 NK cell은 알려진 바이러스 병원체를 다시 만날 경우 다량의 IFN-감마를 생성하며 메모리와 유사한 특성을 갖게 됩니다. 4
종양 제어
세포 독성 T 림프구와 함께 NK 세포는 항종양 면역 반응의 최전선에 있습니다.5 NK cell은 기공 형성 단백질인 perforin이 포함된 세포 용해 과립을 분비하고 비 선택적인 세포막 수송을 유도해 표적 세포를 옵소닌화 합니다.6 또한 분비된 NK 과립에는 표적 세포에서 세포사멸 cascade를 유발하는 granzyme A/B가 포함되어 있습니다. NK cell은 사멸 수용체의 작용기전과 cytokine 분비를 통해 종양 세포의 사멸을 유도할 수 있습니다.7 종양 세포가 면역 반응을 무디게하고 방향을 바꾸는 탈출 메커니즘을 획득함에 따라 NK cell은 이러한 효능을 잃을 수 있습니다. 세포 치료 이식을 위해 NK cell의 확장 및 조작(CAR-NK 세포)이 가능하기 때문에 면역 종양학 연구에서 NK cell의 잠재력이 활용되고 있습니다. 8, 9
항상성
바이러스 및 종양 제어에서 세포독성 역할 외에도 NK cell은 항상성 기능을 수행하고 clearance및 내성의 균형을 맞춥니다. 킬러 면역글로불린 유사 수용체(KIR)와HLA 분자의 결합을 통해 NK 세포는 자신을 인식할 수 있습니다.10 임신중 NK cell은 M2 대식세포와 파트너 관계를 맺습니다. NK cell은 또한 임신중 내성을 촉진하고 배반포의 영양막 침투 (trophoblast invasion)및 나선 동맥 발달에 참여하는데, 이는 엄마와 아이 모두에게 유익하게 작용합니다.11
NK cell 의 활성화 및 억제 수용체 발현을 분석하기 위한 multicolor flow cytometry 패널에 대해 자세히 알아보세요.
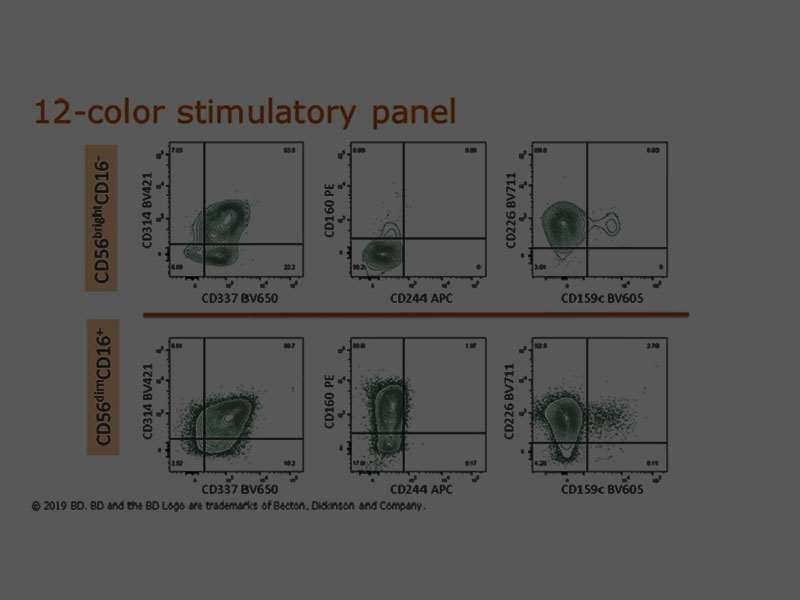
NK cell 웨비나
참고문헌
- Vivier E, Artis D, Colonna M, et al. Innate lymphoid cells: 10 years on. Cell. 2018;174(5):1054-1066. doi:10.1016/j.cell.2018.07.017
- Abel AM, Yang C, Thakar MS, Malarkannan S. Natural killer cells: development, maturation, and clinical utilization. Front Immunol. 2018;9:1869. doi:10.3389/fimmu.2018.01869
- Poznanski SM, Ashkar AA. What defines NK cell functional fate: phenotype or metabolism? Front Immunol. 2019;10:1414. doi:10.3389/fimmu.2019.01414
- Wilk AJ, Blish CA. Diversification of human NK cells: Lessons from deep profiling. J Leukoc Biol. 2018;103(4):629-641. doi:10.1002/JLB.6RI0917-390R
- Fu B, Tian Z, Wei H. Subsets of human natural killer cells and their regulatory effects. Immunology. 2014;141(4):483-489. doi:10.1111/imm.12224
- Hodgins JJ, Khan ST, Park MM, Auer RC, Ardolino M. Killers 2.0: NK cell therapies at the forefront of cancer control. J Clin Invest. 2019;129(9):3499-3510. doi:10.1172/JCI129338
- Osińska I, Popko K, Demkow U. Perforin: an important player in immune response. Cent Eur J Immunol. 2014;39(1):109-115. doi:10.5114/ceji.2014.42135
- Marcus A, Gowen BG, Thompson TW, et al. Recognition of tumors by the innate immune system and natural killer cells. Adv Immunol. 2014;122:91-128. doi:10.1016/B978-0-12-800267-4.00003-1
- Gonzalez-Rodriguez AP, Villa-Álvarez M, Sordo-Bahamonde C, Lorenzo-Herrero S, Gonzalez S. NK cells in the treatment of hematological malignancies. J Clin Med. 2019;8(10):1557. doi:10.3390/jcm8101557
- Boudreau JE, Hsu KC. Natural killer cell education in human health and disease. Curr Opin Immunol. 2018;50:102-111. doi:10.1016/j.coi.2017.11.003
- Faas MM, de Vos P. Uterine NK cells and macrophages in pregnancy. Placenta. 2017;56:44-52. doi:10.1016/j.placenta.2017.03.001
BD Biosciences는 NK cell과 그 기능을 분석하기 위한 여러 tools를 제공합니다.
NK cell enrichment
BD Biosciences는 표적 세포를 positive 및 negative selection으로 분리할 수 있는 자성분리 (magnetic separation) 방법을 제공하고 있습니다. BD IMag ™ Human NK Cell Enrichment Set-DM은 negative selection방법으로 말초혈액에서 NK cell을 분리할 수 있습니다. Biotinylated Human NK Cell Enrichment Cocktail에는 NK cell이 아닌 적혈구, 혈소판 및 말초 백혈구 (NK-T cell 포함)에서 발현되는 항원을 인식하는 단일클론항체가 포함되어 있습니다. BD IMag ™ Anti-Human CD56 Magnetic Particles는 인간과 붉은털원숭이 혈액의 CD56+ cell을 효과적으로 분리하는 것으로 보고되었습니다. 이러한 입자는 BD IMag ™ 세포 분리 자석을 사용하여 CD56 + 백혈구의 positive selection 또는 제거에 최적화되어 있습니다. BD IMag ™ Anti-Human CD3 Magnetic Particles-DM을 사용하여CD56 + 백혈구를 분리하기 전에 T 림프구를 특이 적으로 제거한 후, NK-T cell이 포함되지 않은 NK cell만을 enrichment할 수도 있습니다. 동일한 원리에 기초하여, BD IMag™ Mouse NK Cell Enrichment Set - DM 을 사용하여 마우스 비장 또는 림프절에서 NK cell을 negative selection할 수 있습니다. 이러한negative selection 방법으로 NK cell을 분리할 경우 의도하지 않은 세포 활성화를 막을 수 있습니다.
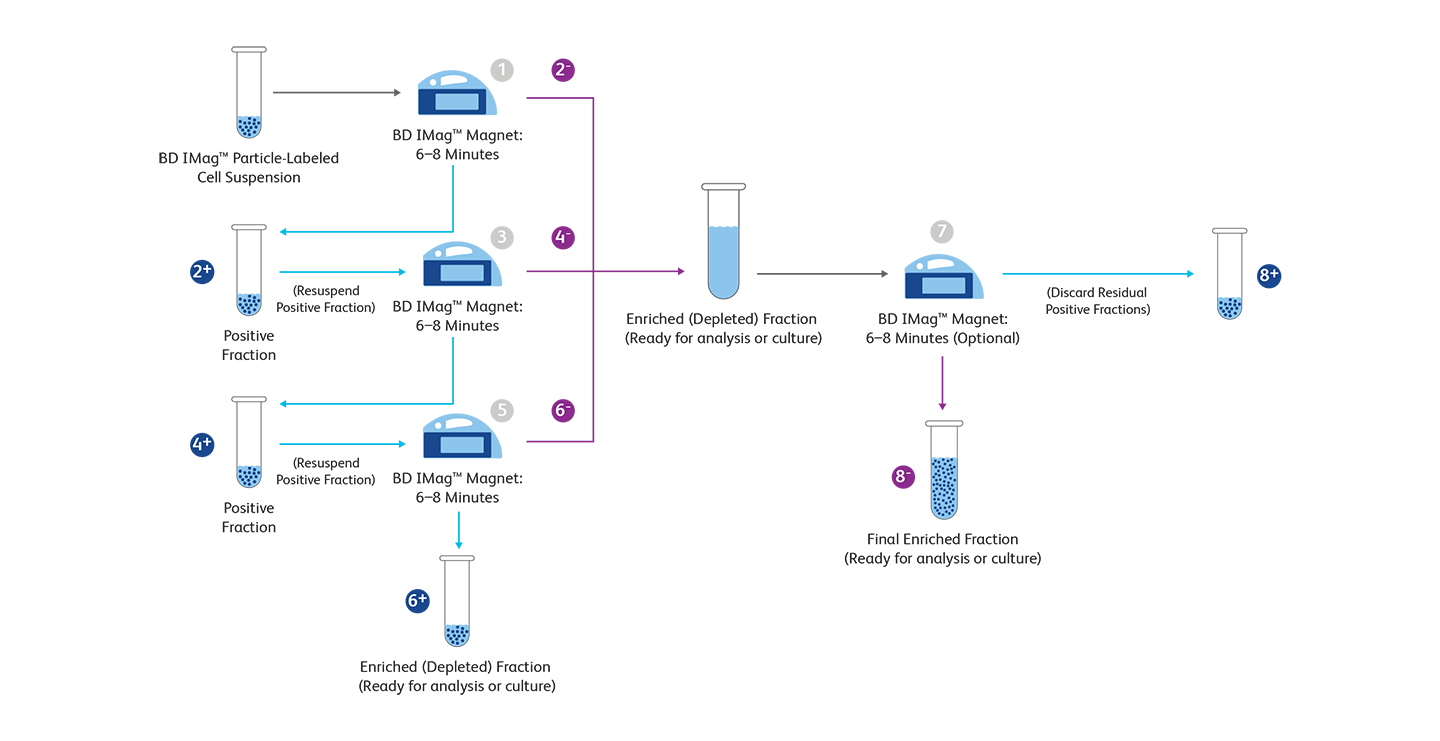
자성 분리 실험 과정
+ 및 –는 각각 positive 및 negative selection 프로세스의 단계를 나타냅니다. 자세한 내용은 자성 세포분리 페이지를 참조하십시오.
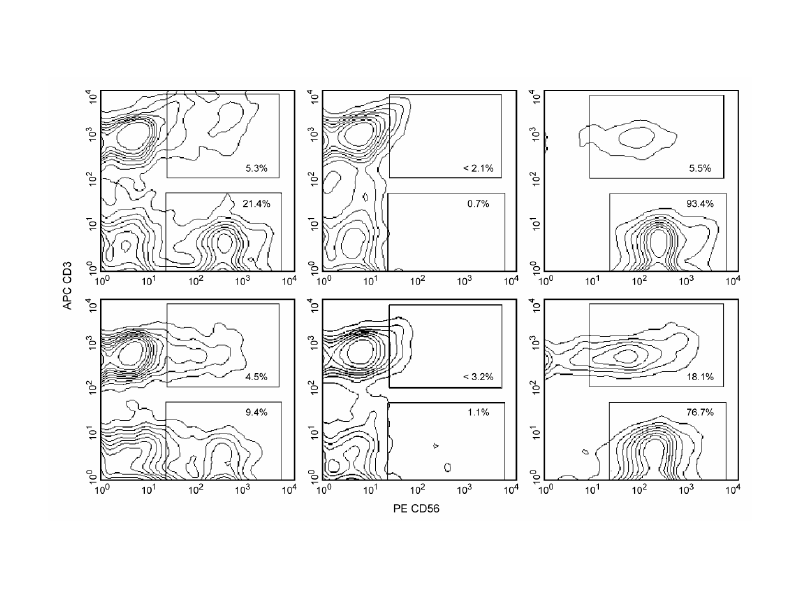
두 개의 다른 공여자로부터 유래된 PBMC로부터 인간 CD56 + NK 세포의 positive 선택.
BD IMag™ Anti-Human CD56 Magnetic Particles-DM(Cat. No. 557775)로 백혈구를 라벨링 후 BD IMag™ Cell Separation Magnet(Cat. No. 552311)을 사용하여 negative(CD56-) 및 positive( CD56 +) fractions을 수집했습니다. Fresh PBMC (왼쪽 패널), negative fraction(중앙 패널) 및 positive fractions(오른쪽 패널)을 PE Mouse Anti-Human CD56(Cat. No. 555516) 및 APC Mouse Anti-Human CD3(Cat. No. 555335)로 염색했습니다. BD FACSCalibur ™ flow cytometry 시스템을 이용하여 분석하였고, 각 샘플에서의 CD56 + CD3-NK cell 및 CD56 + CD3 + NK-T cell의 백분율을 표시했습니다. 각각의 왼쪽 패널과 비교하여 오른쪽 패널에서 더 어두운 시그널을 보이는 이유는 BD IMag particle 표지로 인해 CD56 항체에 의한 CD56 염색이 부분적으로 차단되었기 때문입니다. 전체 CD56 + cell 중 CD56 + CD3 + NK-T cell의 상대적 비율은 공여자마다 다를 수 있다고 보고되어 있습니다. 해당 데이터의 두 공여자는 상대적으로 낮은(상단 패널) 및 높은(하단 패널) 수준의 NK-T cell을 가지고 있음을 확인할 수 있습니다.
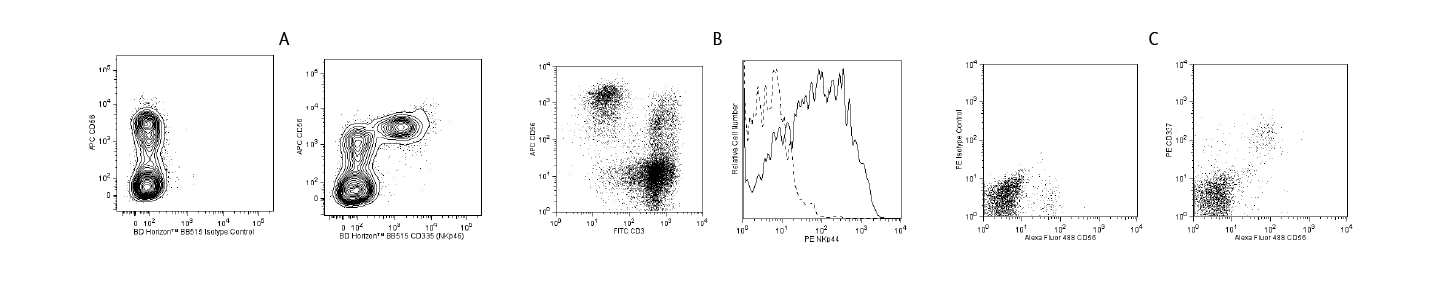
NK 세포 독성
pan NK 마커인 CD56을 포함하여multicolor flow cytometry 패널을 디자인하여 분석하면 NK cell의 세포독성 반응 모니터링이 가능합니다.
자연 세포독성수용체 (NCR) 분석을 위해 CD335 (NKp46), CD336 (NKp44) 및 CD337 (NKp30)을 사용할 수 있습니다. BD Pharmingen™ 및 BD Horizon™ 항체는 multicolor flow cytometry패널의 요구사항에 적합할 수 있도록 다양한 형광 형식으로 제공됩니다.
표면 마커 측정과 함께 인터페론-γ (IFN-γ), 종양 괴사 인자-α (TNF-α)와 같은 세포 독성 cytokine 및 대식세포 염증 단백질-1β (MIP-1β)와 같은 chemokine을 동시에 측정할 수 있습니다.
T cell(CD3), B cell(CD20) 및 NK cell/ 단핵구/대식세포 (CD16)에 대한 표면 마커가 포함되어 있는 BD Pharmingen ™ NHP T/ B/NK Cocktail처럼 즉시 사용 가능한 cocktail에 다른 NK 마커를 추가하여 NK cell의 기능을 구체적으로 프로파일링할 수 있습니다.
BD Biosciences에서 제공되는 민감도가 높은 ELISPOT assays를 이용하여 농축된 NK cell에서 분비되는 인터페론 감마를 측정함으로써 세포 독성 프로파일을 분석할 수 있습니다.
NK 세포 탈과립 assay
Flow cytometry를 이용하여Granzyme과 perforin이 포함된 세포 용해 과립을 많이 가지고 있는 활성화된 NK 세포를 분석할 수 있습니다. 12, 13 BD Pharmingen ™ FITC Mouse Anti- Human Granzyme A 시약 세트 및 BD Pharmingen ™ PE Perforin 시약 세트와 같은 BD Biosciences 시약 세트 포트폴리오를 사용하여 세포 용해 과립의 유형을 flow cytometry로 구별할 수 있습니다.
NK 탈과립 현상은 NK 세포에서 CD107a (LAMP-1)의 표면 발현 확인을 통해 모니터링 할 수 있습니다. 활성화된 NK 세포 집단의 과립 함량은 브레펠딘A를 함유하는 BD GolgiPlug ™ 단백질 수송 억제제를 사용하거나 모넨신을 함유하는 BD GolgiStop ™ 억제제를 사용하여 과립 분비 경로를 차단한 다음 BD Cytofix/Cytoperm ™ 솔루션으로 고정 및 투과화함으로써 모니터링 할 수 있습니다. BD Cytofix/Cytoperm™ Plus 키트는 BD GolgiPlug ™ 또는 BD GolgiStop ™ 억제제와 함께 사용할 수 있고, 형광 표지 된 인터페론-γ (IFN-γ), 종양 괴사 인자-α (TNF-α) 및 대식세포 염증 단백질-1β (MIP-1β)와 같은 chemokine이 있는 BD 항체와도 사용 가능합니다.
NK 세포독성을 분석하기 위한 multicolor flow cytometer패널 디자인에 대해 자세히 알아보세요.
참고문헌
- Tognarelli S, Jacobs B, Staiger N, Ullrich E. Flow Cytometry-based assay for the monitoring of NK cell functions. J Vis Exp. 2016;(116):54615. doi:10.3791/54615
- Shabrish S, Gupta M, Madkaikar M. A modified NK cell degranulation assay applicable for routine evaluation of NK cell function. J Immunol Res. 2016;2016:3769590. doi:10.1155/2016/3769590
연구용입니다. 진단용 또는 치료용으로 사용할 수 없습니다.