Old Browser
Looks like you're visiting us from {countryName}.
Would you like to stay on the current country site or be switched to your country?

면역학
건강한 면역체계는 선천면역 및 적응면역, 항원에 대한 방어, 자기(self)와 비자기(nonself)의 구별, 이전의 감염의 기억, 병원체가 시스템에서 제거되면 공격을 중단하는 능력을 통해 기능합니다. 다양한 유형의 면역 세포, 복잡한 구조 및 정교한 조절을 통해 신체는 항상성을 유지하고 필요에 따라 적응 면역 반응을 활성화할 수 있습니다. 유세포 분석을 사용하면 많은 수의 면역 세포를 정확하고 신속하게 분석하고 enumeration 및 특성분석이 가능하며, 면역 subtype의 특정 표면 및 세포 내 markers를 식별하고 시술 후 면역 세포의 고갈을 평가할 수 있습니다.
선천면역 대 적응면역 반응
선천 면역은 병원체의 보존된 특징을 인식함으로써 병원성 공격에 대한 신체의 일차적이고 즉각적인 세포 반응입니다. 미생물과 관련된 분자 패턴의 인식은 표면 수용체(Toll-like 수용체(TLRs) 및 c-type 렉틴 수용체(CLRs)) 또는 세포질수용체(TLRs, 뉴클레오타이드 결합 올리고머화 도메인 (Nod)-류신이 풍부한 반복 함유 수용체(NLRs), RIG-I-like receptors (RLRs)를 포함하는 패턴 인식 수용체(PRR)에 의해 매개됩니다 PRR은 두 가지 유형의 리간드, 즉 PAMP (병원체 관련 분자 패턴)로 알려진 미생물 병원체의 보존된 구조와 DAMP (위험 관련 분자 패턴)로 알려진 altered-self에서 오는 위험 신호를 인식합니다. 리간드에 의한 PRR의 활성화는 선천면역 세포의 동원과 signaling및 effector molecule(cytokine 및 항균 펩티드)의 분비를 유발하여 병원체 또는 위험을 중화시키는 염증 반응을 일으킵니다. 1이 첫 번째 반응line은 종종 적응 면역에서 초기 반응을 트리거 하기 위한 전제조건입니다.
적응 면역은 B 림프구 (체액)의 IgG (B cell 수용체)와 T 림프구 (세포 매개)의 T 세포 수용체 (TCR)를 통해 유도됩니다. 가변 (V), 다양성 (D) 및 결합 (J) 유전자 절편의 조립을 통한 체세포 재조합은 Ig heavy chain 및 TCR β- chain gene에 의한 다양한 항원 인식을 가능하게 합니다.
선천면역 세포
선천면역 체계는 주로 단핵구, 대식세포, 과립구, NK cell 및 dendritic cells (DCs). 로 구성됩니다.
단핵구
단핵구는 혈액에서 가장 큰 면역 세포입니다. 그들은 몸을 순찰하고 박테리아 및 곰팡이 침입자에 대한 첫 번째 방어선을 제공하고 cytokine 분비를 통해 염증을 일으키고 적응 면역을 유발합니다. 단핵구의 유형에는 CD14 + CD16- (인간), CCR2 + Ly6Chi (마우스)를 특징으로 하는 classical 또는 염증성 단핵구와 CD14lo CD16+ (humans), CCR2lo Ly6Clo (mice)를 발현하는 patrolling 단핵구가 포함됩니다.
대식세포
대식세포의 특징은 침입자의 제거를 지원하고 면역 반응을 priming하는 능력입니다. 그러나 대식세포는 대사와 같은 필수적인 항상성 기능을 가능하게합니다.3 대식세포는 종양 관련 대식세포 (TAM)가 종양 세포에 대한 면역 내성을 유도하는 인자를 분비하기 때문에 종양 발달 및 진행에 대한 관여도가 높습니다. 따라서 면역 종양학에 대한 관심이 높으며 대식세포는 종양 미세 환경 (TME)에 대한 치료의 영향을 평가하는 연구의 핵심입니다. 자극 유도 분극화 (M1 및 M2)를 기반으로 두 가지 주요 대식세포를 설명할 수 있습니다. M1 대식세포는 염증을 일으키고 활성산소(ROS) 생산으로 산화 상태를 촉진하며 염증성 cytokine과 chemokine(예 : IL-1, IL-6, IL-12, TNF-α, CXCL9, CXCL10)을 분비합니다. M2 대식세포는 면역 억제제로 간주되며 IL-10 및 TGF-β와 같은 항염증 인자를 분비합니다.4
과립구
과립구는 세포질 과립이 풍부하고 호염기구5, 호중구6,7, 호산구8 및 비만 세포를 포함하며 면역 요법 동안 숙주 반응을 조절합니다.
Natural Killer cells
NK cell은 일반적으로 선천 면역 세포로 분류되지만, 형태 및 림프 마커의 발현에서 림프구와 유사합니다. NK cell의 특징적인 marker로는 인간 CD16, CD56 및 마우스 NK1.1이 포함됩니다. 10, 11
Dendritic cells
항원 제시 세포인 dendritic cell(DCs)은 항원을 처리하고 적응 면역 세포 T 및 B 림프구에 제시함으로써 선천 면역과 적응 면역을 연결합니다. 세 가지 주요 유형의 DC가 설명되어 있습니다.
- Plasmacytoid dendritic cells (pDCs)는 바이러스 및 종양 세포 인식에 특화되어 있습니다.
- Type 1 classical dendritic cells (cDC1) 는 세포 내 병원균을 인식하고 CD8 T 세포 및 Th1 CD4 T 세포 반응을 유발합니다.
- Type 2 classical dendritic cells (cDC2)는 세포 내 병원체, 기생충, 알레르겐, 곰팡이 및 세포 외 박테리아와 접촉하면서 CD4 T 세포 반응을 유발합니다.
수지상 세포의 기존 마커에는 CD11c, BDCA-1 / 2, CD123 이 포함됩니다12, 13.
훈련 면역이란 무엇입니까?
훈련면역 또는 선천면역 memory는 과거의 침입자에 대한 저항력을 높이기 위해 숙주 반응을 적응시키는 선천 면역 세포의 특성입니다.14 반응은 적응 면역 memory보다 특이성이 낮지만 다양한 유형의 패턴 인식 수용체 (PRR)의 관여를 통해Gram-positive 및 Gram-negative 박테리아와 같은 병원체의 종류를 광범위하게 인식할 수 있습니다.
적응 면역 세포
B 및 T 림프구는 적응면역의 주요 구성 요소이며 병원균에 대해 지연되지만 보다 구체적인 면역 반응을 시작합니다. 15,16
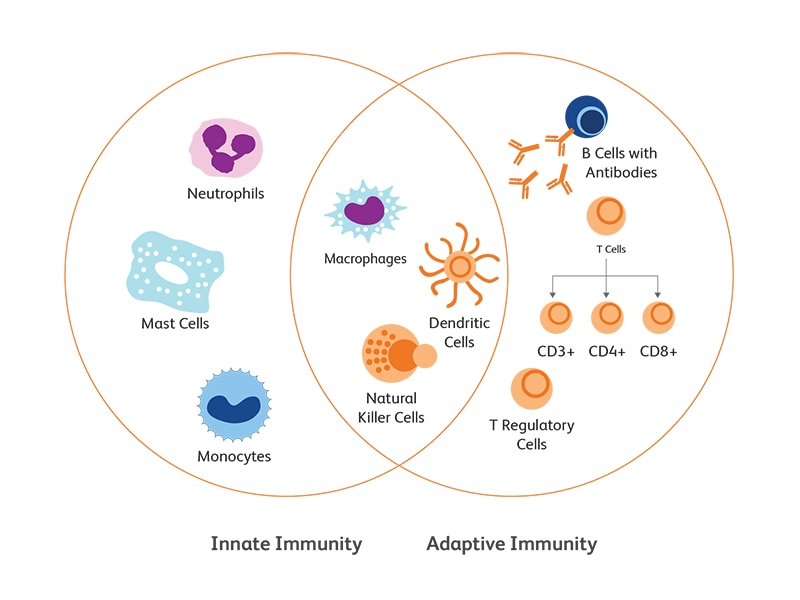
T 림프구
T cell은 골수에서 시작되어 성숙을 위해 흉선으로 이동합니다. T cell의 특징적인 marker는 CD3 및 T cell receptor(TCR)를 포함합니다. 이들은 나중에 다른 표면 분자 CD4 (CD4 + T cell)와 CD8 (CD8 + T cell)의 발현에 의해 분류됩니다. 표면 및 세포 내 marker의 유세포 분석 스크리닝을 통해 T cell subset의 표현형 및 기능을 구별 할 수 있습니다. Th1 (CD3, CD4, IFN-g, CCR5, CXCR3); Th2 (CD3, CD4, CCR3, CCR4, CXCR4, IL-4, IL-10); Th17 (CD3, CD4, CCR4, CCR6, TGFbRII, IL-17, CCL20); CD8 + 세포 독성 T cell, T-reg 또는 regulatory T cell (CD3, CD4, FoxP3, CD25, CTLA4, OX40 / CD134, TGFb, IL-10, IL-35).17
B 림프구
B 림프구 또는 B cell은 골수에서 성숙하기 시작합니다. B 세포는 항체 생산을 통해 체액성 면역을 지원하는 능력으로 알려져 있지만 식균 작용 및 cross-presentation과 같은 다른 주요 기능을 수행합니다. 다른 림프구와 마찬가지로 B 세포의 marker는 성숙과 분화중에 진화하며 CD19, CD27 BCM 및 CXCR4을 포함합니다18.
보체시스템(complement system)
선천면역 및 적응면역 반응이 증가함에 따라, B림프구는 보체 시스템을 포함한 다른 신체 시스템 및 프로세스의 지원을 받습니다. 보체시스템은 세 가지 주요 경로에 관여하는 막결합 및 용해성 단백질 인자의 네트워크이며, 대안적인 complement pathway입니다. 보체 cascade 의 활성화는 궁극적으로 세포 용해로 이어집니다.19
유세포 분석을 이용한 세포의 면역표현형 분석
유세포 분석은 표면 marker 및 항원의 유형을 기반으로 관심 대상 면역 세포 집단을 식별하는데 널리 사용되는 핵심 기술입니다. 림프구 subset을 식별하는것 외에도 이 기술은 rare 세포 유형의 분리, 세포내 cytokine 측정 및 세포의 정량 분석을 가능하게합니다. BD Biosciences는 면역학 연구를 지원하기 위해 여러 연구 세포 분류기, 세포 분석기 및 포괄적인 dye 포트폴리오를 제공합니다.
참고문헌
- Romo MR, Pérez-Martínez D, Ferrer CC. Innate immunity in vertebrates: an overview. Immunology. 2016;148(2):125-139. doi:10.1111/imm.12597
- Heung LJ. Monocytes and the host response to fungal pathogens. Front Cell Infect Microbiol. 2020;10:34. doi:10.3389/fcimb.2020.00034
- Mosser DM, Hamidzadeh K, Goncalves R. Macrophages and the maintenance of homeostasis [published online ahead of print, 2020 Sep 15]. Cell Mol Immunol. 2020;1-9. doi:10.1038/s41423-020-00541-3
- Petty AJ, Yang Y. Tumor-associated macrophages in hematologic malignancies: new insights and targeted therapies. Cells. 2019;8(12):1526. doi:10.3390/cells8121526
- Chirumbolo S, Bjørklund G, Sboarina A, Vella A. The role of basophils as innate immune regulatory cells in allergy and immunotherapy. Hum Vaccin Immunother. 2018;14(4):815-831. doi:10.1080/21645515.2017.1417711
- Liew PX, Kubes P. The neutrophil's role during health and disease. Physiol Rev. 2019;99(2):1223-1248. doi:10.1152/physrev.00012.2018
- Silvestre-Roig C, Fridlender ZG, Glogauer M, Scapini P. Neutrophil diversity in health and disease. Trends Immunol. 2019;40(7):565-583. doi:10.1016/j.it.2019.04.012
- Simon HU, Yousefi S, Germic N, et al. The cellular functions of eosinophils: Collegium Internationale Allergologicum (CIA) Update 2020. Int Arch Allergy Immunol. 2020;181(1):11-23. doi:10.1159/000504847
- Mukai K, Tsai M, Saito H, Galli SJ. Mast cells as sources of cytokines, chemokines, and growth factors. Immunol Rev. 2018;282(1):121-150. doi:10.1111/imr.12634
- Abel AM, Yang C, Thakar MS, Malarkannan S. Natural killer cells: development, maturation, and clinical utilization. Front Immunol. 2018;9:1869. doi:10.3389/fimmu.2018.01869
- Vivier E, Raulet DH, Moretta A, et al. Innate or adaptive immunity? The example of natural killer cells. Science. 2011;331(6013):44-49. doi:10.1126/science.1198687
- Collin M, Bigley V. Human dendritic cell subsets: an update. Immunology. 2018;154(1):3-20. doi:10.1111/imm.12888
- Takenaka MC, Quintana FJ. Tolerogenic dendritic cells. Semin Immunopathol. 2017;39(2):113-120. doi:10.1007/s00281-016-0587-8
- Netea MG, Joosten LA, Latz E, et al. Trained immunity: A program of innate immune memory in health and disease. Science. 2016;352(6284):aaf1098. doi:10.1126/science.aaf1098
- Netea MG, Schlitzer A, Placek K, Joosten LAB, Schultze JL. Innate and adaptive immune memory: an evolutionary continuum in the host's response to pathogens. Cell Host Microbe. 2019;25(1):13-26. doi:10.1016/j.chom.2018.12.006
- Flajnik MF. A cold-blooded view of adaptive immunity. Nat Rev Immunol. 2018;18(7):438-453. doi:10.1038/s41577-018-0003-9
- Mousset CM, Hobo W, Woestenenk R, Preijers F, Dolstra H, van der Waart AB. Comprehensive phenotyping of T cells using flow cytometry. Cytometry A. 2019;95(6):647-654. doi:10.1002/cyto.a.23724
- Martínez-Riaño A, Bovolenta ER, Mendoza P, et al. Antigen phagocytosis by B cells is required for a potent humoral response. EMBO Rep. 2018;19(9):e46016. doi:10.15252/embr.201846016
- Lubbers R, van Essen MF, van Kooten C, Trouw LA. Production of complement components by cells of the immune system. Clin Exp Immunol. 2017;188(2):183-194. doi:10.1111/cei.12952
연구용입니다. 진단용 또는 치료용으로 사용할 수 없습니다.
Report a Site Issue
This form is intended to help us improve our website experience. For other support, please visit our Contact Us page.